脊椎動物の「休眠状態」の分子メカニズム





エラー;Saw ASCII character 10 but expected 33-based Phred qual.
今回は管理人が困ったトラブルの解決法
~seqのマッピングで困ったことが起きた。
fastqをトリミングする前はちゃんとマッピングされる(bowtie)のに、トリミングするとなんだか下のようななエラーが出てしまうというもの。。
Saw ASCII character 10 but expected 33-based Phred qual.
ググってみるとちゃんとダウンロードできているか?とか書いてあるが、トリミング前は問題なく走るのでそこではないだろう。
で、色々調べていると、
トリミングで0bpのリードが出てきてしまうのが原因らしい。
そういうわけで
cutadaptのオプション、-mで1bp以上のリードだけとってくればよかったらしい。
(実際これで解決する)
とくにウェット系の人だと同じようなことで困る人も多いかもしれないので、今後もぼちぼち管理人がつまづいたエラーをあげていこうかな。。
発生時計の同調メカニズム
★今回は筆頭著者の吉岡さんからコメントを頂きました。ぜひ最後までご覧下さい!★
何兆個もの細胞からなる私たちの体は、受精卵というたった一つの細胞から生まれる。この受精卵から体が出来上がる過程において、多くの現象があらかじめ決められたタイミングで自律的に進行していく。
この発生タイミングを決める発生時計が細胞内で正確に時を刻み、細胞間で厳密に同期することが、複雑で精密な個体の発生を可能にするために極めて重要である。
これまでに発生時計が個々の細胞内で時を刻むメカニズムについては数多くの研究からその一端が明らかになりつつある。しかしながら、発生過程において個々の細胞の発生時計がどのように他の細胞と同期し、適切なタイミングでの運命転換を細胞の集合体として可能にしているかはあまり明らかではなかった。
そこで今回、体節形成をモデルにして細胞間で発生時計が同期するメカニズムに迫った論文を紹介する。

-----
発生時計の研究のモデルとしてよく使われるのが、背骨や筋肉の基となる体節が形成される前駆組織であるPSM (presomatic mesoderm, 未分節中胚葉)である。
興味深いことに、マウスPSMにおいては個々の細胞でHes7やLfngといった遺伝子の発現が約2時間という周期をもって振動(オシレーション)することが知られる。

これまでに、これら遺伝子発現の振動にはDll1やNotchの糖鎖修飾の機能を持つLfngが重要であることが分かっていて、LfngをKOすると組織レベルのHes7のオシレーションの振幅が小さくなり、体節形成が異常になることが報告されてきた。
しかしLfng KOによるオシレーション振幅の減弱、あるいは体節形成の異常は
①PSMのそれぞれの細胞におけるHes7の振幅が小さくなったことが原因か、
②細胞間のシンクロができなくなったことが原因か、
③両方ともが原因なのか
は明らかではなかった。
なぜなら、従来の解析法(主にライブイメージング)では解像度が低く、1細胞レベルで何が起こっているかわからなかったからだ。
そこで筆者らは、Hes7-Achilesという蛍光レポーターを新たに作製し、PSMの組織カルチャーを行うことにより、1細胞レベルでオシレーションを解析した。
その結果、Lfng KOマウスでは、1細胞あたりのHes7発現の振幅、周期といったオシレーションの異常とともに、周囲の細胞とのシンクロの度合いの低下が観察された。
Legend;Lfng KOではHes7の発現の振幅が小さく、細胞間のシンクロの度合いも低下していた。

---
では、Lfng KOの振幅の低下は個々の細胞における内在のオシレーションの振幅の低下に由来するのだろうか、それとも、細胞間のシンクロの異常に由来するのだろうか。
この疑問を解決するため、筆者らは、細胞をバラバラにまき隣接する細胞とは接触しない条件において、Hes7の発現を観察した。その結果、LfngをKOしてもHes7のオシレーションの振幅に大きな変化はなかった。このことから、PSMで観察されたLfng KOのHes7振幅の減少は、細胞間のシンクロの異常によって引き起こされた可能性が示唆された。
では、細胞間のシンクロを制御するにあたって、Lfngはシグナルを受け取る側の細胞で重要なのだろうか?それともシグナルを受け渡す側の細胞で重要なのだろうか?
この点に迫るため、次に筆者らは、コントロールとLfng KOの細胞を混ぜた
- 少数のWTの細胞をWTの細胞中に混ぜた時 (1:20)
- 少数の WTの細胞をLfng KO細胞中に混ぜた時 (1:20)
- 少数のLfng KO細胞をWTの細胞中に混ぜた時 (1:20)
の3条件において、Hes7のオシレーションの様子を観察し、少数の細胞と多数の細胞の間でのオシレーションのタイミングのズレを定量した。

このとき驚くべきことに、bのWT細胞では、周囲のLfng KO細胞よりも1/8周期早くHes7の発現がオシレーションしていることが分かった。
このことから、シグナルの送り手の細胞でLfngがノックアウトされている場合には、Notchシグナルの伝達速度がWTよりも速くなる、すなわち送り手の細胞においてLfngがNotchシグナルの伝達を遅めている可能性が示唆された。
一方、cのようにシグナルの受け手の細胞でLfngがノックアウトされた場合には、Hes7のオシレーションの振幅が小さくなっており、周囲のWTの細胞と位相が同期していなかった。
このことから、受け手の細胞でLfng がノックアウトされると、周囲のWTからのDll1シグナルに正常に応答できていない、すなわち受け手の細胞におけるLfngは特にNotchを受け取る過程において、Hes7オシレーションを増幅している可能性があると考えられた。
これらのデータから、送り手の細胞においてLfngはNotchシグナル伝達を遅める役割と、受け手の細胞においてシグナルを受け取った時のHesの振幅を大きくする役割がある可能性が示された。
さらに数理モデルにおいても、LfngによるNotchシグナル伝達の時間遅れの調節は同位相のオシレーションに重要であることが示唆された。
---
では、Lfngノックアウトで早くなってしまっているシグナル伝達を人工的に遅くすることで、Lfngノックアウトの表現型を回復させることができるだろうか?
そこで筆者らは、ES細胞から誘導したPSM様細胞に431分子をかけ、シグナル伝達の遅れを引き起こす分子があるかをスクリーニングした。その結果、26 分子がHes7の振動周期を10min以上長くすることを発見する。
最終的に、KYO211という分子がLfng をノックアウトした PSM細胞でHes7のオシレーションと振幅の大きさと同期率をある程度レスキューした。
このことから、シグナル伝達の遅れがLfngのノックアウトによる表現型をレスキューできることが分かった。
---
結果は以上のような感じで、この研究から、新しいツールにより単一細胞解像度でオシレーションの様子を観察できるようになり、Lfngにより生み出される細胞間のシグナル伝達の時間遅れが細胞集団としてオシレーションを同調させるのに重要であることが分かった。
この結果は体節形成の異常を治療する方法の確立につながるだけでなく、生物がどのように時を刻んで正常な発生を可能にしているかという生物学の根源的な疑問に近づくヒントになる可能性がある。
---
★筆頭著者の吉岡さんからコメントです!
私たちの研究結果をご紹介頂き、ありがとうございます!
今回の論文の出発点は、マウスにおいて未だ実現していなかった、PSMのライブイメージングによる「体節時計遺伝子のオシレーションの一細胞レベルの可視化」です。この解析システムの構築は、理化学研究所 脳神経科学センターの宮脇敦史先生、新野祐介先生が開発された新規の蛍光タンパク質Achillesを用いることで劇的に進みました。
次にこのシステムを最大限に使って、今まで解っていなかった何を明らかにできるか?ここは本当に手探りでしたが、幾つかの変異体を観察する中で、手がかりをつかみ、あの手この手(分散培養、共培養、数理シミュレーション、オプトジェネティクス)でLfngを介した同期機構の解明にアプローチしました。自然界に広く見られる様々な振動現象にも共通する可能性のある新規の知見を、マウスを使った実験で示せたことは、意義がある仕事ができたのではないかと思います。
吉岡はレポーター開発、ライブイメージング、画像解析、数理シミュレーション、オプトジェネティクスに関しては完全に初心者でしたので、たくさんの方々にお助けいただきました。特に数理シミュレーションは東大の郡宏先生との共同研究で行いましたが、このような複雑でダイナミックな現象を理解する上では必須のツールであると感じました。
実は7年かかったプロジェクトでして、途中大変な局面は色々ありましたが、試行錯誤しながら、色々な発見と学びがあり概ねずっと楽しかったです。
個人的には1回目のリバイスを返す少し前に出産を致しまして、産後一ヶ月はゆっくり休みましたが、その以降はずっと怒涛の日々を駆け抜けました。寝不足のあまり記憶がうっすらとしかありません。(緊急の出産だったのでこのような成り行きとなりましたが、かなり身体は負担を感じましたので、人にお勧めするものではないです。)
ライフプランと研究生活とのすり合わせはなかなか難しいですが、まあ何とかなるさ〜と思いながらやっています。これからも価値ある面白い仕事を続けたいです。
---
掲載論文
Coupling delay controls synchronized oscillation in the segmentation clock, Nature, 2020
(リンク)
減数分裂のスイッチ因子「MEIOSIN」の発見
★今回は筆頭/責任著者の石黒先生からコメントを頂きました!ぜひ最後までご覧ください!★
細胞の分裂は、同じDNA情報を複製した後に同じコピーを持つ娘細胞を作り出す体細胞分裂と、精子・卵子を作り出す際に染色体数を半減させる減数分裂に大別される。
減数分裂は体細胞と同様の細胞周期の機構を転用しながらも、減数分裂仕様の染色体構造が再構成されるようにプログラムされている。すなわち減数分裂は生殖細胞で行われ、二本の相同染色体において組み換えが行われたのち2回の分裂を経て染色体数が半分になる。(図1参照)

減数分裂ではゲノムの混ぜ合わせが起きるため、減数分裂は生物の多様性を生み出す原動力になっている。(さらに二本の相同染色体を物理的に繋ぎ留めるキアズマと呼ばれる構造は第一分裂で見られる染色体半数化の分配に必須の役割を果たすと考えられる。)
体細胞分裂と比較した場合、減数分裂ではゲノム半数化の染色体分配を実行する“第一分裂”が挿入されている点が両者の本質的な相違を与えていると解釈される(図1)。体細胞分裂から減数第一分裂への切替えが何によって制御されているのかという問題は、生物種を問わず長年の懸案とされていた。
この重要性にも関わらず、生殖細胞において分裂様式を体細胞分裂から減数分裂へと切り替えるスイッチ因子は分かっていなかった。
今回は、これまで機能不明、遺伝子名すらもアノテーションされずにデータベース上で眠る因子が減数分裂を誘導するスイッチであることを発見し「MEIOSIN」と名付けた論文を紹介する。

-----
これまで、減数分裂にはSTRA8という遺伝子が重要な働きをすることが知られていた。STRA8は卵子や精子で発現し、欠損させると減数分裂が異常になることが報告されていた。
しかしながら、STRA8は特徴的な機能ドメインやモチーフが見当たらないためその機能を予測できないこと、マウスの系統によってはSTRA8が欠損していても減数分裂じたいは開始すること、STRA8は減数分裂期以外のステージでも発現がみられること、などからSTRA8以外にも減数分裂の開始に重要な別の因子が存在する可能性が推定されてきた。
そこで、筆者らはSTRA8に結合するタンパク質を網羅的に解析することで、減数分裂の開始に重要な因子を探索した。
減数分裂が開始するタイミングに相当する生殖細胞の数は精巣内でも少なく、またSTRA8の発現は一過的であるため、効率良くSTRA8を精製するストラテジーが必要であった。このために、STRA8にタグを付加して、GFPで光るようにデザインしたノックインマウスを作成し、質量分析によりSTRA8に結合するタンパク質を同定した。
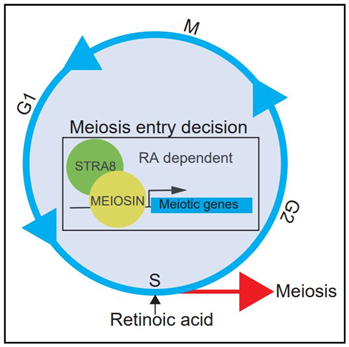
この結果Gm4969という未解析遺伝子にコードされるタンパク質がSTRA8に結合する可能性があることが判明した。さらに後述するように、この遺伝子が減数分裂の開始(meiosis initiation)に重要であることが示されたのでこの遺伝子をMEIOSIN(マイオーシン)と名付けている。
マイオーシンはbHLHとHMGというドメインを持ち、DNAに結合して転写因子のように働くことが予想される因子である。(図2)

マイオーシンの発現を免疫染色で検討すると、マイオーシンのタンパク質はオスメス両方の生殖細胞において減数分裂が開始する時期に発現が一過的に上がっていることが分かった。
これらの結果から、これまで機能不明とされていた遺伝子、マイオーシンが減数分裂に関わっている可能性が示唆された。
------
ではマイオーシンはどのような機能があるのだろうか?
筆者らはCRISPRによりマイオーシンを欠損させたマウスを作成し解析を行った。
この結果、驚くべきことに、マイオーシンがノックアウトされたマウスでは減数分裂がおこらなくなり、精子や卵子が作られないことが分かった。
さらに解析を行うとマイオーシンが欠損した精巣では、細胞周期の維持に関与する体細胞型Cyclinの異所的発現やM期様染色体構造など体細胞様の特徴を示す細胞の蓄積を伴って、減数分裂に入ることができなくなっていることが分かった。
実際RNAseqを用いて遺伝子発現を網羅的に解析すると、マイオーシンの欠損により減数分裂に重要な遺伝子の発現が減少していることも示している。
すなわち、マイオーシンこそが生殖細胞において分裂様式を体細胞分裂から減数分裂へと切り替えるスイッチとなっている可能性が示唆された。
-----
では、マイオーシンはどのようにして機能を発揮するのだろうか?
マイオーシンはDNA結合ドメインをもつことが示唆されるため転写因子として働くと予想された。そこで筆者らはマイオーシンがゲノム上のどこに存在するかを検証した。
この結果、マイオーシンは遺伝子のプロモーター領域によく結合していること、さらにマイオーシンは多くの減数分裂に関わる遺伝子の近くに結合していることが明らかになった。
このことから、マイオーシンは減数分裂に関わる多数の遺伝子の発現を包括的に制御するマスターレギュレーター的な働きをしている可能性がある。
-----
今回の研究により、MEIOSINこそがこれまで探し求められてきた減数分裂を誘導するスイッチ因子である可能性が示された。
これは減数分裂という多くの種で広く保存されていて、非常に重要な生命現象のメカニズムの一端を明らかにした点で極めて重要な結果である。
より研究が発展すれば、不妊治療などの医療の応用につながる可能性もある。
以下Graphical Abstract。
-----
管理人コメント
論文掲載おめでとうございます!
結合因子探索実験から名無しの遺伝子をとってきてばっちり表現型出ているのはめちゃすごいと思いました。
最近は何とかseqから始める論文も多いですが、免疫沈降のような生化学からでもまだまだ面白いことが分かるんだぞ、というのは印象的でした。
ちゃんとした名前がついていない遺伝子でも、減数分裂のような重要な生物学的に関わっているというのも驚きでした。まだまだこういった遺伝子は眠っているかもしれないと思うとわくわくします!
----
★筆頭/責任著者の石黒先生からのコメントです★
減数分裂がバッタの生殖細胞で始めて観察されて100年以上の時が経つ。減数分裂は中学、高校の理科教科書にも登場する今では古典とも言える生物学の基本現象なのだが、減数分裂の開始制御に関わる空前の事実を突き止めたことはお驚きでした。今回研究を進める中で、MEIOSINのターゲットのなかには多くの遺伝子が機能未解明のまま眠っていることが判明しました。現在当研究室では、少人数ながらこれら機能未解明の遺伝子の減数分裂における役割の解析を進めています。
また今回発見したMEIOSINは脊椎動物でのみ保存されていることがわかりました。体細胞分裂から減数分裂への切り替えをトリガーするする因子は他の生物ではまだ同定さていませんが、おそらく同等の役割を果たす因子があるだろうと思われます。このような研究に興味をもつ大学院生やポスドクの参加をお待ちしています。
-----
掲載論文
MEIOSIN Directs the Switch from Mitosis to Meiosis in Mammalian Germ Cells, Developmental Cell, 2020(リンク)
参考
https://www.s.u-tokyo.ac.jp/ja/story/newsletter/keywords/19/03.html
図1; https://www.brh.co.jp/publication/journal/060/research_21.html
インプリント鎖が脳発生に重要!?(筆頭著者による論文紹介)
★今回は筆頭著者による論文紹介ということで、東京大学大学院薬学系研究科分子生物学教室(後藤由季子研究室)の今泉さんに解説記事を書いていただきました。コメントも書いて頂いたのでぜひ最後までご覧ください!★
-----
私たち哺乳動物の体細胞は父親と母親由来の染色体を持つ二倍体であり、ほとんどの遺伝子は父方鎖と母方鎖のどちらの染色体からも同程度に発現し同様の機能を果たします。
一方、およそ150の遺伝子においては、片方の染色体が抑制され発現しなくなる現象、ゲノムインプリンティングが知られており、一般的に、片親由来のアレルのDNAがメチル化されることによって発現が抑制され、もう片親由来の遺伝子のみが機能を担うと考えられています。
これまで、ゲノムインプリンティングは、いったん形成されると抑制されたアレル、インプリント鎖からは発現が見られない、と考えられてきましたが、近年の研究により、特に脳においてはいくつかのインプリント鎖からも発現が検出されることが明らかとなりました。
興味深いことに、一部の遺伝子については、これらインプリント制御が異常になると精神疾患が引き起こされるという報告もあります。
私は、新たに父性インプリント遺伝子であるCdkn1cのインプリントされた父方鎖が脳発生において重要な働きをしていることを報告しました。

-----
Cdkn1c は、サイクリン依存的リン酸化酵素阻害タンパク質ファミリーに属するp57Kip2 をコードし、通常父方鎖が発現抑制されています。
これまで母方鎖は神経系前駆細胞において発現し脳発生に寄与することが知られていましたが、父方鎖は機能を持たないと考えられていました。
そこでまず、脳においてCdkn1c父方鎖の発現が検出されるかどうかを、父方鎖と母方鎖を区別することができる定量PCRを用いて調べました。
その結果、神経系前駆細胞およびニューロンにおいてCdkn1c父方鎖の発現が母方鎖の約1%程度ながらも検出されることがわかりました。
---
次に、神経系においてCdkn1c父方鎖には機能はあるかを調べるため、神経系特異的にCdkn1c父方鎖のノックアウトをおこないました。
まず始めに、生後60日目においてコントロールと父方鎖ノックアウトマウスの脳を取り出してみたところ、驚いたことに全体的な脳の縮小が観察されました。
特に大脳新皮質に着目すると、Cdkn1c父方鎖をノックアウトした脳では、下層ニューロンの数に大きな変化は見られない一方で、上層ニューロンの数が顕著に減少していることがわかりました。
大脳新皮質においては、異なる種類のニューロンが6層の層構造を形成しています。
各層のニューロンは、胎生期の神経系前駆細胞から順々に産生され、特に胎生初期には下層ニューロンを、胎生後期には上層ニューロンを生み出すことが知られています。
Cdkn1c父方鎖がノックアウトされた脳では特に上層ニューロンが減少していたことから、上層ニューロンを産み出す時期において前駆細胞の数が減ったのではないかと考えました。
この可能性を免疫染色によって検証すると、実際、上層ニューロンを産み出す発生後期において神経系前駆細胞の数の減少していることが分かりました。
(一方、下層ニューロンを産生する発生後期においては神経系前駆細胞の数におおきな変化は見られませんでした。)
最後に、神経系前駆細胞の減少の原因を検証しました。
Cdkn1c父方鎖をノックアウトした脳において、細胞死マーカー陽性細胞が顕著に増加することが観察されたことから、Cdkn1c父方鎖ノックアウトによってアポトーシスが亢進していることがわかりました。
このことから、アポトーシスの蓄積によって胎生後期の神経系前駆細胞が減少し、それが原因となって生後の上層ニューロンの減少が引き起こされた可能性が考えられます。

全体の結果をまとめると、これまで機能がないと思われていたCdkn1cのインプリント鎖(父方鎖)からわずかながらもRNAが発現していること、そしてインプリント鎖が脳発生に非常に重要な役割を果たし、特定のサブタイプのニューロンを生み出すのに貢献していることを見出しました。
近年の研究により、脳においては複数のインプリント遺伝子について、インプリント鎖からの転写が検出されることが明らかとなりました。本研究はCdkn1cをモデル遺伝子として、なぜインプリント鎖が脳において活性化されるか、という意義に迫ることができる可能性を示しており、非常に興味深いと考えています。
★コメント★
取り上げていただき大変光栄です。
ゲノムインプリンティングは脊椎動物の中で哺乳類にのみ見られ、比較的限定された遺伝子において見られる特殊なメカニズムです。
なぜ哺乳類は「片方の染色体がバックアップとして働く」という2倍体のメリットを犠牲にしてまで、ゲノムインプリンティングの機構を持つのでしょうか。私はその疑問に惹かれて研究を続けています。
これまで、インプリンティング制御と脳機能が関わっているのでは?と考えられてきましたが、検証する手法がまだまだ開発されていないこともあり、未解明な点が多く残されています。
この論文は、Cdkn1cインプリント鎖の存在が脳発生に重要だったという内容ですが、機能面の解析だけではなく、父方鎖と母方鎖を区別することができる定量PCRといった手法の開発も推しポイントだと思っています。
今後も、手法開発を含めて様々な角度から、インプリンティングの謎、特に「脳発生や精神疾患とどのように関わるか」について迫っていきたいと考えています。
-----
発表論文
Role of the imprinted allele of the Cdkn1c gene in mouse neocortical development, Scientific Reports, 2020 (リンク)
-----
バイオステーションでは、筆頭著者の方による論文紹介を募集しています。どのような分量でも構いませんので、ぜひご寄稿いただけると幸いです。
詳細につきましては、以下のリンクもご覧ください
脳転移がんはエクソソームによって転移を容易にしている!?
★今回の論文紹介はなんと共筆頭著者の星野先生からのコメントを頂いております。最後までご覧いただければ幸いです★
現代において、日本人の2人に1人はがんにかかり、3人に1人はがんで亡くなるといわれる。
がんの治療が難しい原因の一つとして、がんが「転移」することが挙げられる。
転移があると、初めにがんができた場所で手術を行っても、転移した先のがんが大きくなることで治療は失敗してしまう。
このため、「がんがどこに転移するのか予測すること」、「がんの転移を止めること」は、がん治療における大きなゴールの一つである。
---
では、がんはどのように転移するのだろうか?
これまでに、がんが転移するためには転移先の環境を転移に適したものにする必要があると考えられてきた。
しかしながら、このがん転移先の環境を変化させ臓器特異性を決める実体は長らく不明であった。
驚くべきことに2015年、「エクソソーム」こそが、エクソソーム中に含まれるインテグリン組成に応じて特定の臓器に取り込まれ、そこで環境を変化させることでがん細胞の臓器特異的な転移を誘導すること、が報告された(Hoshino et al., Nature, 2015、新着論文レビュー)。
*エクソソームはがん細胞を含む多くの細胞が分泌する直径30~150 nmほどの小胞であり,タンパク質,RNA,DNAなどが含まれる。ただのゴミだと思われていたころもあったが、近年エクソソームには多様な機能があることが分かってきている。
この報告から、特に肺転移や肝臓転移に関してはエクソソーム(とそこに含まれるインテグリン)が重要であることが分かってきた。
また、致死率も高いことで知られる脳転移についても、脳転移性がんのエクソソームは脳に取り込まれやすいことは分かっていた。
しかし、脳転移性がんのエクソソームを転移先の環境を変化させることにエクソソームが寄与するのか、もし寄与するのであれば、どの分子が重要で、それが脳内環境にどう関わるのか、という点は不明であった。
そこで今回、がんの脳転移においてもエクソソームが転移先の環境に変えるのに重要であること、そして予測や治療にも応用できる可能性を示した論文を紹介する。

-----
先に述べたように、肺に転移しやすいがんはエクソソームによって肺の環境を変えて肺に転移しやすい環境をつくること、同様に肝臓に転移しやすいがんはエクソソームによって肝臓の環境を変えて肝臓に転移しやすい環境をつくること、が示されてきた。
では、脳に転移しやすいがんのエクソソームは、がんが脳に生着しやすい環境を作るのだろうか?
これを調べるために、筆者らは脳、肺、骨にそれぞれ転移しやすい乳がん細胞からエクソソームを単離し、それらエクソソームを切片培養した脳にかけることでがんの生着が増加するか検討した。
その結果、期待通り脳に転移しやすいがんのエクソソームをかけておくと、脳切片上でがんが生着しやすいことが分かった。
これは、脳転移がんはエクソソームによって脳の環境を変化させ、がんが生着しやすいようにしているというモデルを支持する。

---
このとき、脳に転移しやすいエクソソームに含まれるどのようなタンパク質が重要なのだろうか?
この点を明らかにするために、筆者らはプロテオミクス解析によって、脳、肺、骨にそれぞれ転移しやすいがん細胞のエクソソームに含まれるタンパク質を網羅的に解析した。
この結果、CEMIP(シーミップ)というタンパク質が、脳に転移しやすいがんのエクソソームに多く含まれることが分かった。(一方、興味深いことに肺や骨に転移しやすいがんと対照的にインテグリンはそれほど含まれなかったらしい)
CEMIPは、Wnt経路の制御、ヒアルロン酸代謝、細胞内カルシウム濃度制御などに関わることが知られてきた因子で、がんや脳での機能も少し報告されてきた。
しかしながらもちろん、エクソソーム中のCEMIPにがん転移を容易にするような効果があるかは不明であった。
---
では、CEMIPは脳に転移しやすいがんが脳の環境を変化させ、がんが生着しやすいようにするのに重要なのだろうか?
筆者らは、脳転移しやすいがん細胞でCEMIPをノックアウトしエクソソーム中にCEMIPが含まれないようにした条件すると、脳の環境変化ひいてはがんの脳転移が抑制されるか検討した。
この結果、CEMIPをノックアウトした細胞からのエクソソームで処理すると通常の脳転移しやすいがんに比べ、培養系にいてがんの生着が弱まるとともに、個体において脳に転移する腫瘍の大きさが30%程度になることが分かった。
すなわち、脳に転移しやすいがんのエクソソームに含まれるCEMIPこそが脳内をがんが生着しやすいような環境に変化させ、がんの脳転移を容易にしていることが分かった。

---
それでは、がんのエクソソームは脳のどの細胞に取り込まれているのだろうか?そして具体的にどのような状態変化をもたらすのだろうか?
筆者らはこの点に取り組み、(少し端折ってしまうが)結果的に脳に転移しやすいがんのエクソソームは脳の内皮細胞とマイクログリアに取り込まれやすいこと、そして内皮細胞はがん細胞が抱きつく(vascular co-option)ことができる形質へと形質変化していることを明らかにしている。これががん細胞の足場となり増殖しやすい環境になっていると考えられる。
さらに、CEMIPのノックアウトすると内皮細胞の形態変化はみられなくなることから、この変化の一部はCEMIPに依存していたことが分かった。
また、エクソソームの取り込みよって、炎症関連因子や細胞接着因子などの発現が変化していることをRNAseqを用いて網羅的に解析している。
---
ここまでで、脳に転移しやすいがんのエクソソームに含まれるCEMIPが脳をがん転移しやすい環境にするのに重要であることが、主にモデルマウスによって示されてきた。
そこで最後に、ヒトの患者さんでもCEMIPの発現と脳転移には相関があるか検証した
このためにがんをCEMIPの発現の高さによってクラス分けし、その転移状態をヒトのサンプルと用いて調べた。
その結果、CEMIPを高く発現していると脳転移が増加することが明らかになり、ヒトの患者においてもCEMIPによって脳転移が容易になっている可能性が示唆された。
---
結果はおおよそ以上で、今回の報告により
- 脳転移しやすいがんはエクソソームにより脳をがん転移しやすい状態に変化させていること
- とくに脳に転移しやすいがんのエクソソームに含まれるCEMIPというタンパク質が重要なこと
- 脳に転移しやすいがんのエクソソームは内皮細胞やマイクログリアに取り込まれ、内皮細胞の性質を変化させること
- ヒトにおいてもCEMIPの発現と脳転移には相関があること
が明らかになった。
この結果はエクソソームを介した脳転移における脳内環境変化の分子メカニズムを明らかにした点で非常に大きな発見である。
また生物学的な面白さに留まらず、エクソソームやCEMIPによる脳転移の予測と治療につながる可能性示した点で臨床応用にも重要である。
より研究が進めば、「がんがどこに転移するのか予測すること」、「がんの転移を止めること」が可能になる日も近いかもしれない。
-----
★共筆頭著者の星野先生からのコメントです!
取り上げていただき大変光栄です!
2015年に報告した、がん転移の臓器特異性にがん由来エクソソームが寄与する、という論文で行なった実験と同時期にこの研究も始めていました。当初は、肺、肝臓、脳転移を全てみていく、という流れだったので。しかし、結果的に、脳転移は肺や肝臓などの臓器と異なる点が多くより時間がかかりました。
脳転移の実験を行う難しさとしては、同所移植モデルが非常に少ない点だと思います。また、エクソソームが脳関門を通過してどれほど脳内へ入り込めているのか(エクソソームは非常に小さいため1エクソソームの取り込み、は観察できません)、さらに、脳関門を通過した様に見えるエクソソームの量で(とても少なく見えました!)前転移ニッチが形成できるのか、など不安要素が多く先ずはex vivoの実験からスタートすることとなりました。さらに、肺や肝臓とは異なりエクソソームによるインテグリンの含有量が少なく、これについても新たな検討が必要となりました。途中で投稿先論文を変更する、という流れもあり、先に出ていた論文から4年後にこうして発表できる状態となりました。
今後の展望としては、エクソソームに含まれるタンパク質のプロテオミクス解析を用いた機械学習を行い”がんvs.非がん”、“がんの種類”、“未来転移先予測”、など網羅的な解析から導き出されるエクソソームを用いたバイオマーカーキットの開発を行なっていきたいと思います。
また、エクソソーム生物学としては、細胞へ取り込まれた後のエクソソームはどうなっているのか(トラフィッキングされてる?)、などイメージング解析も興味あります。さらに、1細胞から産生されるエクソソームがどれほどヘテロなのか、1微粒子レベルでの解析も行なっていきます。
最も重要な今後の研究テーマとしては、エクソソームによるがん進展機構をターゲットとした治療ができるのかどうか。エクソソームがトリガーとなる変化を未然に防ぐことができるか、取り込まれた後の変化を抑制することができるか、その辺りにも迫っていきたいと思います。
そして、エクソソームの臓器特異的取り込みはがん以外の疾病でも確認できています。このあたりについても近い将来ご報告できたらと思っております。
一緒に研究していいただける方を募集しております!ご興味あるかたは是非ご連絡いただきたいです!
-----
今回の論文
- Tumour exosomal CEMIP protein promotes cancer cell colonization in brain metastasis, Nature Cell Biology, 2019 (リンク)
2019年生命科学研究まとめ&2020年展望
--
![]()