細胞老化に伴う細胞核状態の変化
今回は細胞の老化とクロマチン状態の関係について迫った論文を紹介
細胞は無限に増殖し続けられるわけではなく、ある状況下において細胞増殖を停止させることが知られている。
この細胞増殖の停止は細胞老化と呼ばれ、SA-β-galの蓄積、細胞周期抑制因子p16やp21の活性化、SASP(Senescence-associated secretory phenotype)の誘導が共通してみられる。
この共通点を持ちながら、細胞老化には大きく以下の2種類に分類される。
1.原がん遺伝子による細胞老化 (OIS; Oncogene-induced senscence)
2.増殖回数が限界を迎えることによる細胞老化 (RS; Replicatice senescence)
この2つで大きく異なるのは細胞核の状態であり、
1.原がん遺伝子による細胞老化(OIS)では核内にクロマチンが凝集した老化関連ヘテロクロマチン凝集粒(senescence-associated heterochromatin foci; SAHF)が現れる
2.増殖限界による細胞老化(RS)では核が膨潤し各染色体が凝集する
ことが知られてきた。
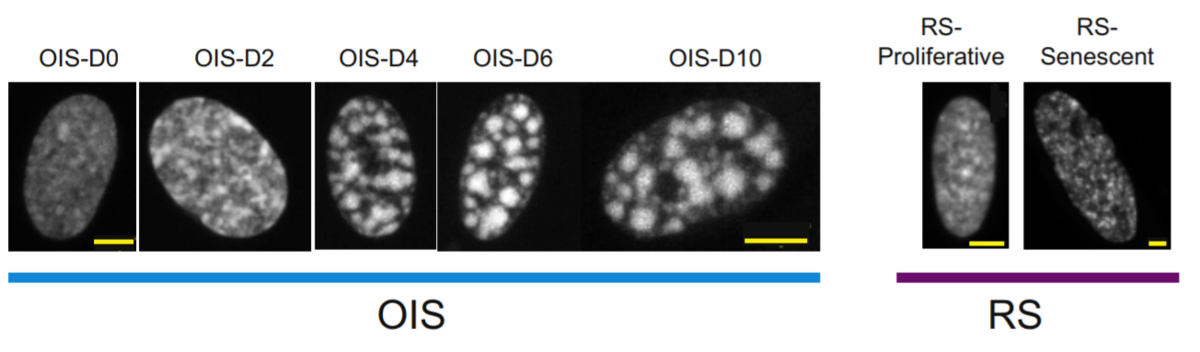
この見た目にもはっきりした細胞老化のパターンの違いにもかかわらず、この2パターンでどのようにゲノムの状態が異なっているのか、分子的に2パターンを分けるものはなにか、ということは十分には分かっていなかった。
今回の論文では、この2パターンの細胞老化におけるゲノム状態の違いを網羅的に解析し、この2パターンを分ける分子メカニズムに迫った。

-----
(Hi-C; Chromosome conformation capture法。細胞内でゲノムをクロスリンクさせ制限酵素で切断したのちにシーケンスすることで、近接するゲノム領域を網羅的に解析することができる。)
その結果、いずれもLong range interactinが強くなることが分かった(下図)。

----
では、OISとRSの細胞老化でゲノム状態はどのような差があるのだろうか?
そこで筆者らはこれらコンパートメントについて解析を行った。
その結果、興味深いことに、2パターンの細胞老化では相互作用の変化様式が異なり
1.増殖限界による細胞老化ではA-A相互作用が弱くなり、A-B相互作用が強くなる
2.原がん遺伝子による細胞老化ではA-B相互作用が弱くなり、B-B相互作用が強くなる
ことが分かった。(下図)

細胞老化といってもゲノム構造の変化様式は結構異なるのが面白い。
----
この後筆者らは、原がん遺伝子による細胞老化(OIS)でみられる核の凝集粒SAHFに着目する。
このSAHFの形成に重要な因子を特定するため、筆者らはいくつかのクロマチン因子をノックダウンしSAHFの形成を検証した。
この時下図のように、DNMT1というDNAメチル化酵素をノックダウンした際に、SAHFの形成が異常になることが分かった。

---
ではDNMT1が欠損したときゲノムの状態はどのように変化しているのだろうか?
筆者らはDNMT1をノックダウンさせた状態でHiCを行った。
その結果、驚くべきことに、DNMT1をノックダウンした状態で、原がん遺伝子による細胞老化(OIS)を誘導すると、なんとゲノム状態は増殖限界による細胞老化(RS)に似ていることが分かった。
なのでDNMT1こそが細胞老化の2パターンを分けるのに重要な因子なのかもしれない。

(ちなみに、DNMT1の活性あるいは量がOISとRSで違う、というデータがあったほうがいいような気がするのだが見つからなかった。)
ではなぜDNMT1がSHAFの形成に寄与するのか、というのを検証。詳細は省くがDNMT1はSAHFの形成に重要なことが知られているHMGAの発現を抑制する因子を抑制しているようだ。
(このあたりのデータは正直甘いのではないかというのが管理人の感想)
あとは、これら細胞老化によるゲノム構造の変化したゲノム領域において遺伝子発現の変化もありそうだよ、というデータを出している。
----
管理人のコメント
同じ細胞老化でもゲノム構造からみると結構異なる特性を思っているのは面白い。
じゃOISとRSの核構造の変化がどういう細胞状態としての違いに効いているのかがわかるともっと良い(これは自分の勉強不足もあるが)。
最近HiCが普及、解析ツールも整ってきたので核構造を見る論文はもっと増えていきそうですね。
----
今回の論文、画像はすべて論文から引用(一部改変)
4D Genome Rewiring during Oncogene-Induced and Replicative Senescence, Molecular Cell, 2020 (リンク)