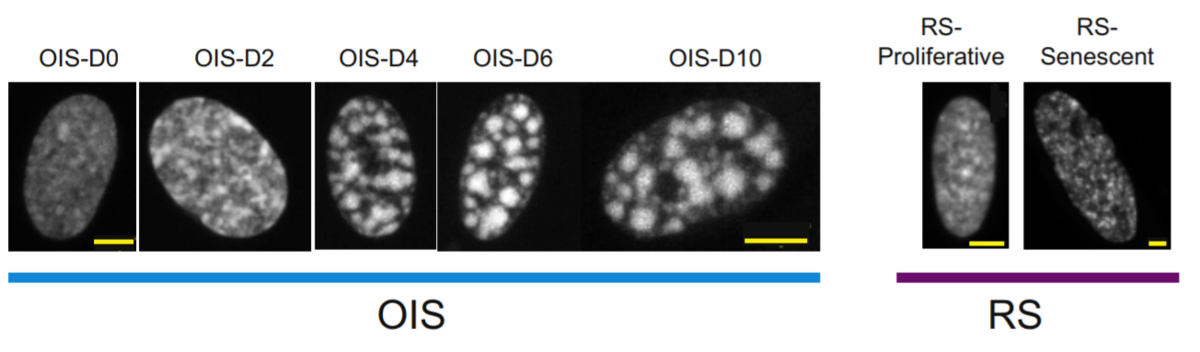
細胞老化に伴う細胞核状態の変化





タンパク質なしにリポソーム内部に特定の物質が濃縮される現象の発見_筆頭著者による論文紹介
今回は筆頭著者の論文紹介として、東京大学大学院総合文化研究科、豊田太郎研究室の杉山博紀(すぎやまひろのり)さんに記事をご寄稿いただきました!ぜひ最後までご覧ください!
----
生命はどのようにして誕生したのか,生命科学に携わる人なら一度は考えたことのある疑問ではないでしょうか.生命の構成単位である細胞の中には様々な生理的な機能が実装されています.無数の生理的な機能一つ一つがあまりに精妙にできていて,いったいどうしたらそれらが一つのシステムとして統合されたものを自発的に組み上げられるのか,これは生物学の最大の謎の一つと言っても過言ではないでしょう.
複数のシステムの統合は差し当たって長い進化の歴史に任せるとして,ある特定の機能一つに限定してみましょう.機能が生まれるには,最低限なにかしらの分子がある程度以上の濃度で区画の内部に存在する必要があります.しかし今日の細胞において,この「濃度を高く保つ機能」はチャネルやポンプなど,複雑な分子システムによって実装されています.そんなシステムがある日偶然現れなくてはいけないのでしょうか.こうしてみると,無数の機能の統合どころか,ある一つの機能が実装された細胞様のシステムを組み上げることさえ困難なように思えます.
今回紹介する論文は,ひょっとするとこのパラドックスに対する一つの回答になっているかもしれません.
具体的には,
細胞サイズのリポソーム*1を自動計測する実験プラットフォームを構築し,実験精度とスループットを両立したデータ取得を可能にしました.さらに本プラットフォームを利用して,酸性リン脂質を含む細胞サイズのリポソームを外部流れ場によって基板表面に押し当てながら特定の分子の水溶液に曝すことで,それらの分子のリポソーム内部の濃度を外水相よりも高く(=濃縮)できること
を発見しました(図1).

この結果は,
- 何もしなければ自発的には濃縮が起こらないリポソームと分子の組み合わせにおいて,外部流れ場というありふれた状況に曝すだけで濃縮を実現できた
という現象としての面白さと,
- 細胞サイズのリポソームを自動で計測できる実験プラットフォームを構築した
という方法論の進展という二つの観点から重要です.
さらに,推測を多大に含みますが冒頭に述べたような,
- 本結果を生命起源や初期進化という観点から眺めると,豊かな視点が広がるかもしれない
という点でもきわめて興味深い現象を発見したのではないかと考えています.
現象自体がめっちゃおもろい
細胞は内部の分子の濃度をコントロールしています.細胞内部のほうが外部よりも濃度が高い状態を維持していることも珍しくありません.これは細胞が,タンパク質などによってATPに蓄えられた化学エネルギーを消費しながら能動輸送をしているからです.しかし,本研究で用いたリポソームには,タンパク質は一切含まれていません.
「濃縮」を非対称な濃度分布の実現と考えれば,たとえば膜を透過できない分子と半透膜を適切に組み合わせることで,ある分子の濃縮が膜を介して進むこともあり得ます.しかし,今回用いた分子の水溶液とリポソームを混ぜて放っておくだけでは,濃縮は起こりませんでした.
しかしこのリポソームを,外部流れ場によって基板と接触させながら特定の分子の水溶液に曝すと,リポソーム内部のその分子の濃度が外部よりも高くなっていったのです.
膜を介した輸送動態が,外部流れ場が引き起こした膜と基板の物理的な接触のみによって質的に変化するというのは驚くべきことです.
さらに,本現象は最初ウラニンという蛍光性の水溶性分子で発見されましたが,蛍光標識されたATPも同様の条件で濃縮できることがわかりました.ATPといえば細胞内のエネルギー通貨としてよく知られたものです.
リポソーム内部に生体機能性分子を内包した,いわゆる「人工細胞」を創成することは構成的アプローチの主要な方法論です.しかしリポソーム膜を介した輸送は通常遅く,人工細胞の機能が長時間持続させられないという点が一つの技術的困難でもありました.ATPが効率的に人工細胞内部に送達・濃縮できることを示した本研究は,長期間に亘って活性を示すような人工細胞の創出につながるかもしれません.脂質膜を介した奇妙の輸送動態という基礎科学的な興味以外にも,人工細胞研究の観点などいろいろな夢が広がる発見といえます.
なんでこんな発見ができたのか?
この現象のポイントは,酸性リン脂質を含むリポソームを用いるという点と,外部流れ場によって基板表面に押し当てながら特定の分子の水溶液に曝すという実験設定です.
しかしある日突然「よし,今日は酸性リン脂質を含むリポソームを作ってそれを基板に押し当てながら適当な分子に曝してみよう!」と思ったわけではありません.思えるわけがありません.
きっかけは,開放骨折でした.
私は修士課程のころはずっと有機合成をしており,博士課程でも合成を主軸にした計画を練っていました.しかし,修論を出し終わった直後に自宅の階段から落ちて,気が付いたら左腕から骨が突き出ていて,運よく1か月くらいで退院はできたのですが(幸い後遺症も残りませんでした),有機合成どころではなくなってしまったのです.何もしないのも暇だったので,計測系でも作っとこうかなと考えました.
近年,微細加工技術を使って観察したい対象に最適化した分析チップを開発する研究が盛んに進められています.これらの分析チップはマイクロ流体デバイスと総称されます.
私はこれまでに,リポソームを捕捉し顕微鏡の一視野内にアレイ化するマイクロ流体デバイスを開発していました(図2).細胞サイズのリポソームの同時並列計測は,従来法ではブラウン運動のせいで技術的に困難でしたが,本デバイスはこれを容易にします.また,リポソームの位置を固定しながら外溶液を交換できます.このため,スループットと精度を両立しながら,高い実験自由度で(どんな溶液をどんな濃度でどんなタイミングで,また,複数種類の溶液をどんな順番で流すか,など)リポソームの刺激応答性を計測できます.

しかし,いろいろなことができるということは,いろいろなことをやらなければならないということでもあります.リポソームのようなメソスケールの分子集合体をきちんと制御する方法論にはまだ暗中模索のようなところも多く,どうしても網羅的な条件探索のようなことが必要になってきます.網羅的な探索といえば聞こえはいいですが,要は何も考えず色々やるということで,あまり人間的な行いではありません.
ということで,マイクロ流体デバイスを使った実験を自動で出来るようにしました(図3).デバイスに溶液を流し入れるためのシリンジポンプ,流す溶液の種類を制御するためのバルブ,観察するための顕微鏡ステージ,光源とシャッターユニット,カメラなどの周辺機器を統合的に制御するプログラムを作りました.このプログラムを,撮影した画像をその場で画像解析するプログラムと組み合わせ,解析結果をもとに系をフィードバック制御出来るようにしました.あらかじめメソッドを組んでおけば,腕を骨折している人でも,たとえば18時くらいにセットアップを終えて(リハビリにおすすめです),Enterボタンを押してプログラムを起動し,家に帰ってご飯を食べて寝て,起きて朝ご飯を食べてラボに戻ってくると,画像解析まで済んだ状態のデータが出ているというようなことができます.

本手法は非平衡状態にある分子集合体の機械支援型同時並列対話型計測(Machine-Assisted Numerous, Simultaneous, and Interactive Observation of Non-equilibrium self-assembly)の略として,MANSIONsと名付けました.広域空間(=大豪邸;mansion)に住んでいるリポソームたちを並列計測することにちなんでいます.
さて,装置のプロトタイプができたら性能試験が必要です.私の開発したマイクロ流体デバイスでは,広域の円形空間にリポソームを一つずつ捕捉します.その後,流れる外溶液を切り替えることでリポソームの外環境を制御する(図2上段参照)のですが,リポソームの捕捉によって外溶液の置換に要する時間が変わるかもしれません.この時間は捕捉されたリポソームの大きさにも依存するかもしれません.そこで,リポソームを捕捉後,外溶液を蛍光性の水溶性分子の水溶液に置換する過程を計測してみたのです.
結果としてリポソームの捕捉の有無は置換に要する時間にはほとんど影響を与えなかったのですが,そんなことよりこの写真を見てください(図4).

明らかにリポソーム内部のほうが背景よりも強い緑色蛍光を示しています.共焦点顕微鏡で見ると,膜(赤)のラインプロファイルは二峰性で中央が暗く,内部の蛍光性分子(シアン)は単峰性で中央が明るくなっています.素直な解釈としては,蛍光性分子は確かに内部に入っていて(膜の外側に堆積しているわけではない),かつ内部の濃度が外部より高いということになりそうです.
しかし実をいうと,初めてこの画像を見たとき私は本当に濃度が高くなっているのだとは思いませんでした.普通に考えればまああり得ないからです.初めてこのデータをボスに見せたときのディスカッションも,こんな見え方になってしまうアーティファクトってどんなものが思いつきますか?というようなものでした.
本現象をそれ以上追及するべきか少し悩みました.いろいろやってみても結局ただの勘違いだったということになるかもしれません.しかし偶然骨が折れていて他にやることがなく,代わりに自動実験装置がありました.どうせ寝ている間にデータを取ってくれるのだし,本当に濃度が高いなんてことがあったらすごいし,装置のパフォーマンステストもかねてやってみるか,みたいなノリで始まったのです.どこにお宝が眠っているのかわかったものではありません.
最近Lab-Automationは様々な文脈で注目を浴びています.その際の論点は,再現性の担保やデータのスケーラビリティ,探索の網羅性などではないかと思います.ただもしかすると,自動化しておくことで妙な現象を本気で検討する際の心理的なハードルが下がるということも,とても大きなポイントなのではないかと思います.
とはいえ自動化されていたとしても,どうやったら本当に濃度が高いと自分を含め相手を納得させられるか,論文を完成させるのには,本当に骨が折れました.
生命起源を考えるとめっちゃめちゃおもろいかもしれない
今日の生命システムが進化的に生じてきたものであるという観点に立って本研究の結果を考えてみると,より豊かな視点が開けるのではないかと私は考えています.
今日私たちが目にする生物はすべて進化によって成立してきたはずです.しかし,生命起源に近い始原的な環境で成立し得るような単純な化学システムに進化可能性を実装するのは,よく考えてみるととても難しい問題です.もしその実装にそんなに選択肢がないとすると,生命起源における細胞様の化学システムの設計原理は,今日の細胞にまで通底する最も基本的なシステムの設計原理を捉えているかもしれません*2.
興味深いことに,今回の濃縮には分子依存性があります.
酸性リン脂質というのは,言い換えればアニオン性のリン脂質ですが,今回の研究の範囲で濃縮が確認された分子はいずれもアニオン性の電荷をもつ分子でした.他方,アニオン性でない分子の水溶液を用いた場合や,アニオン性のリン脂質を含まずに形成させたリポソームでは濃縮は確認されませんでした.
上述した通り,最初期の生命様の化学システムに,どのようにして進化可能性を実装し得たのかというのは大きな謎です.進化可能性の実装には少なくとも何らかの機能が必要であり,機能が生まれるためにはある程度の分子濃度,すなわち濃縮された状態が必要です.
もしも濃縮にはある特定の電荷が必要だ(あるいは膜の電荷との組み合わせ)というようなことになったらどうでしょうか.生命のような複雑なシステムを最初に作るときには,電荷のそろった膜と基質の組み合わせでしか第一歩を踏み出せないとすれば,後々のシステムの設計思想にも大きな影響を与えそうです.
そう思ってみてみると,生体内の重要な機能性物質,たとえばATPとかDNAとかってアニオン性だよな...そういえばアミノ酸の等電点って7以下のものが多いような...
本当でしょうか.
本当だったら面白いですね.
---
(補足1)リポソーム
リン脂質が水中で袋状の二分子膜を形成した分子集合体.イメージとしては,細胞から細胞質,オルガネラ,その他諸々を除去して,最外層の膜構造だけにしたもの(下図).

ドラッグデリバリーの担体としての応用的利用のほか,構成生物学(補足2も参照)の文脈では,細胞の化学モデルの足掛かりとしてよく利用される.特に本研究では,原始細胞のモデルと見立てている.
(補足2)構成的なアプローチと生命起源と進化と濃縮
(1)構成的アプローチ
生物学の伝統的な方法論は,複雑な系を要素に分解して考える還元的なアプローチといえます.一方,この20年で,細胞の「設計原理」の理解を目指す動きが活発化してきました.本研究は,細胞様の化学システムを構成し,単純化されたモデル系を実験的に調べるという,構成的アプローチの中に位置づけられます.
構成的アプローチの問題意識を説明する際,しばしば,コンピューターを理解するにはどうするか,というアナロジーで語られます.チップセットを調べたり,とりあえず分解してみて使われているねじの品番を調べたりという行為が生物学の伝統的な還元的なアプローチに対応します.
しかし,この例でいえば,チューリングマシンを理解することなしに「コンピューターを理解した」と思う人は,まずいないでしょう.とすると問題は,チップセットを調べるだけで,果たしてチューリングマシンにたどり着けるだろうか,ということです.
分解して調べるだけではなく,今あるコンピューターのようにふるまう系を構成してみようとすることで,初めてわかることもあるのではないかというのが根底にある一つの問題意識といえます.もちろん構成的アプローチは,分解して理解するというフェーズをすでにある程度経ているからこそできることであり,いわば還元的なアプローチと相補的な方法論ととらえることができます.
(2)構成的アプローチと進化
作ってみると簡単に言っても,現在の細胞は素晴らしく精妙にできているので,すべてを模倣することは(少なくともしばらくは)不可能です.何に着目してどう実装するか,何をもってモデルの良し悪しを判断するのか.明快な道筋はありません.
一つのありうる方向性として,シンプルな系に進化可能性を実装するにはどうしたらよいか?という問いがあると私は考えています.今日の生命システムたちはある日突然生じてきたのではなく,連綿と続く長い進化の歴史の中で徐々に形成されてきたものです.逆に言えば,今日の生命システムに至るすべての過程において,「進化可能であるべし」という制限が要請されていたはずです.どんなに素晴らしい機能を備えていても,進化可能性を失ってしまったらその時点でそのシステムの歩みは止まってしまうからです.この進化可能性への要請は原始地球に初めて生じた最初期の生命様のシステムにとっても同様のはずです.しかし,進化可能な最初期の生命様のシステムとして,どんな実装がありうるでしょうか.もしその実装にそんなに選択肢がないとすると,それ以降のあらゆるシステムはこのシステムを進化的に拡張しながら成立していくわけですから,始原環境での設計原理は,もしかすると今日の細胞にまで通底する最も基本的な設計原理になっているかもしれません.
こうした問いにも,やはり作ってみながら考えるのがよさそうです.
(3)生命起源と濃縮
濃縮と生命起源の関係についても考えてみます.どんなシンプルな系を想定するにせよ,進化可能性が宿るということは何らかの機能があるということです.機能が宿るには,それなりの濃度の分子が,細胞のような区画に閉じ込められている必要があります.外水相の濃度が高ければ,受動輸送で区画の中にもそれなりの濃度の分子が入るでしょう.でも,そんな状況だったら区画はもはや必要ないし,外部にそれだけの分子が既に存在しているという状況も不自然です.能動輸送を実現する膜タンパク系が存在していれば問題は解決します.タンパク質だけなら,偶然に生成されてもいいかもしれません.しかし,タンパク質がきちんと働くには,それと協調した膜システムが不可欠です.そんな複数の要素が互いに依存しあうようなシステムはどうしたら生じるのでしょう.シンプルなシステムから進化できればいいのですが,今問題にしていたのは,まさにどうしたら進化できるかというところから話が始まっており,トートロジーが発生しています.
本研究で示したような,非生物的な過程のみで細胞様の区画の中に濃縮できるということは,このトートロジーのスタート地点を覆せるかもしれません.
-----
バイオステーションでは、引き続き筆頭著者による論文紹介を募集しています!
詳細はこちらをご覧ください(リンク)。ご連絡お待ちしております。
ヒストン修飾と相互作用する新規タンパク質の網羅的同定


ヒトらしい脳ができる分子メカニズム
今回はヒトらしい脳ができる分子メカニズムに迫った論文を解説。筆頭/責任著者の難波さんからコメントを頂いていますので、ぜひ最後までご覧下さい!
目次
管理人による論文解説
ヒトは進化の過程で体の大きさに比して大きな脳を獲得してきた。ヒトを特徴づける高次な思考や感情は、この大きな脳によって支えられていると考えられている。
では、ヒトはどのように大きな脳を獲得してきたのだろうか?
近年の研究により、進化の過程で大きな脳を獲得できた大きな原因の一つは、神経細胞を生みだす"神経幹細胞"の振る舞いにあることが分かってきつつある。
なぜなら、神経幹細胞がより増殖するとそれだけ神経細胞を生みだす"もと"が多くなるので、脳の肥大を引き起こすことができるためである。実際、ヒトはマウスに比べて神経幹細胞の数が多いことが知られている。
このため、このヒトらしい神経幹細胞の振る舞いを決める遺伝子を多くの研究者が探し求めていたものの、近年までその実体は不明であった。
2015年、ドイツのWieland Huttnerのグループが、ついにヒトの脳が大きくなった原因となる遺伝子の候補を同定する。

この論文では、ヒトとマウスを用いて神経幹細胞に発現する遺伝子を網羅的に探索することで、ヒトの神経幹細胞で高く発現する遺伝子を同定することに成功する。
この中でも、ヒトが進化的にチンパンジーと別れた時に獲得した遺伝子"ARHGAP11B"に着目する。
ARHGAP11Bをマウスの脳に過剰発現させると神経幹細胞の増殖が亢進し、驚くべきことにマウスの脳にシワができることを示している。
このように、ARHGAP11Bはヒトらしい脳を作るのに大事な遺伝子である。
しかしながら、ARHGAP11Bがどのようなメカニズムでヒトらしい脳の形成に貢献するのか?、という点は大きな疑問として残されていた。
そこで今回は、同じくWieland Huttnerのグループから報告された、ARHGAP11Bタンパク質の働くメカニズムに迫った論文を紹介する。

---
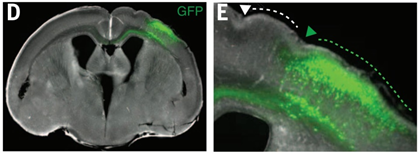
ARHGAP11Bの働くメカニズムに迫るには、まずARHGAP11Bが細胞内のどこにいるのかを知ることが重要である。
そこで、筆者らはARHGAP11Bに特異的な抗体を作成し、ARHGAP11Bの局在を検証した。
すると進化的にARHGAP11Bの祖先となったARHGAP11Aは細胞核に存在するのと対照的に、ARHGAP11Bはミトコンドリアに局在することが分かった。(以下の図参照)

また、このミトコンドリアへの局在には、ARHGAP11BのN末端に存在するミトコンドリア標的配列が重要であることも示している。
(ちなみに興味深いことにN末端にHAタグをつけたARHGAP11Bはタンパクの電荷が変わることでミトコンドリアには局在しなくなるらしい。タグ付けた時は注意ですね)
---
ではARHGAP11Bが"ミトコンドリアに局在すること"が神経幹細胞の増殖を促進するのに重要なのだろうか?
この点を検証するため、筆者らは通常のARHGAP11Bと並べて、ミトコンドリアに局在できなくなるARHGAP11B(ミトコンドリア標的配列を削った変異体と、HAタグをつけた変異体)をマウス脳に過剰発現することで神経幹細胞の増殖が変化するか検討した。
ここでは結果をお示しするが、正常なARHGAP11Bはbasal(図で言うところの上側)での神経幹細胞の増殖を増加させるが、ミトコンドリアに局在できない変異体ではこの効果はみられない。
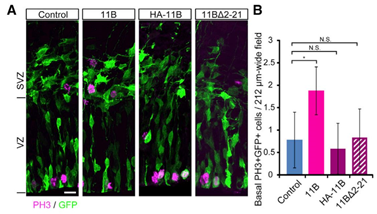
このことから、ARHGAP11Bは"ミトコンドリアに局在すること"で神経幹細胞の増殖を促進することが示唆された。
---
では、ARHGAP11Bは、ミトコンドリアに局在しその下流でどのような変化をもたらすことで神経幹細胞の運命を制御しているのだろうか?
この点に迫るため、筆者らはARHGAP11Bに結合するタンパク質をプロテオミクスにより網羅的に探索した。
その結果、ANT1, ANT2, PiCというタンパク質がARHGAP11Bに結合することを明らかにする。筆者らはこの中でも、ANT2とARHGAP11Bとの結合に着目して解析を行っている。
まず、先ほどと同じような手法により、ARHGAP11BとANT2をマウス脳に過剰発現することで神経幹細胞の増殖が変化する検証した。
すると、ARHGAP11B過剰発現による神経幹細胞の増殖亢進はさらにANT2を過剰発現することでキャンセルされるので、 ARHGAP11BはANTと結合することでその機能を阻害していることが示唆された。

では、ANT2はどのような遺伝子だろうか?
ANTはミトコンドリア内膜に存在することが知られていて、
①ミトコンドリア膜間のADP/ATPの輸送
②Ca2+などの濃度決定に重要なミトコンドリア膜透過性遷移孔(mPTP)の制御という大きな二つの働きがあることが知られている。
(以下、ミトコンドリア膜透過性遷移孔をmPTPと表記)
筆者らはまずATP/ADP交換が変化しているか培養細胞の系で検討を行うが、ARHGAP11Bを過剰発現してもATP/ADPの状態には大きな変化はみられなかった。
そこで、mPTPの形成/開口状態がARHGAP11Bによって変化するかを検討するため、ARHGAP11Bを過剰発現しmPTPの状態を観察した。
その結果、ARHGAP11Bの過剰発現によりmPTPの開口が遅れることが明らかになった。

というわけで、mPTPの開口がARHGAP11Bで制御されそうであることが分かった。では、mPTPの開口は神経幹細胞の運命に重要なのだろうか?
筆者らは、mPTPを阻害することが知られるCsAという低分子化合物を導入し、細胞運命を検証した。
すると以下の図のように、Basal(上側)での神経幹細胞の増殖が増加した。すなわち、mPTPの開口は神経幹細胞の増殖を制御している可能性が示唆された。

では、さらにさらに、mPTPはどのようにして細胞運命を制御しているのだろうか?
少し割愛させて頂くが、結果的にmPTPの下流として有名なグルタミン分解が重要らしいというのを見出している。
実際、低分子化合物によってグルタミン酸分解をヒト脳の組織で阻害すると神経幹細胞の増殖が減少することが示されている。
グルタミン酸分解はグルタミンをグルタミン酸に変換する反応で、下流でTCAサイクルが回るので、グルタミン酸分解が亢進すると細胞増殖に必要なエネルギー源が豊富に得られることが想定されるらしい。
-----
以上の結果から、
①ARHGAP11Bはミトコンドリアに局在して働くこと
②ARHGAP11BはANT2と結合し、ミトコンドリア膜透過性遷移孔の開口を制御すること
③その下流で細胞内代謝状態、特にグルタミン酸分解を制御すること
が明らかになった。
モデル図は以下のような感じ(論文から引用)

管理人コメント
2015年の論文が出た時からヒトらしい脳をつくのに重要な遺伝子としてARHGAP11Bは存じ上げていたのですが、どうやって働いているんだろうなぁ、というのは確かに不思議に思っていました。
今回ミトコンドリアでの代謝制御が大事ということが分かったのですが、近縁の遺伝子(ARHGAP11A)とは全く異なる場所、役割で働いているというので結構驚きました。近い遺伝子だから似たような仕組みで働いているんだろうというのは悪い思い込みですね。
また、細胞内代謝状態の変化が大事、というのも勉強になりました。神経幹細胞でミトコンドリアやリソソームが大事という報告も相次いでいますし、遺伝子発現制御に重きを置いてしまいがちな自分の見方を変えていかないといけないと思います。
この研究で、ARHGAP11Bがどのようにしてヒトらしい脳を作るのに貢献しているのかクリアになった気がします。もちろんARHGAP11Bだけでヒトと他の種の違いがすべて説明できるわけではないので、これからの研究でヒトがヒトらしい脳を獲得してきた過程がより詳細に分かっていけば面白いです!
------
★筆頭/責任著者の難波隆志さんからのコメント
この度は、私どもの論文を取り上げていただきありがとうございます。この論文の内容、重要性に関してはバイオステーションの管理人様がわかりやすくまとめてくださっているので、これ以上付け足すことはありません。私からはこの仕事を終えての感想を少し述べさせていただきたいと思います。この仕事に取り掛かったのが2014年の秋口だったと思いますが、それから2017年の夏まではARHGAP11Bの細胞内局在は未知のままでした。その原因はN末にHAタグをつけたARHGAP11Bを実験に用いていたからです。理由としてはC末が機能ドメインであることは別の実験でわかっていたので、C末にタグをつけるよりはN末にタグをつけた方がよいとの「思い込み」があります。このような「思い込み、先入観」を一度持つと、それにとらわれず実験を組み立てるのが困難になってしまうこともあるかと思います。若い読者の皆様におかれましては、自分が思い込み・先入観にとらわれていないかを今一度客観的に判断することによって、研究テーマの迷宮入りを避けていただけることが出来たらと思います。
-----
今回の論文
Human-Specific ARHGAP11B Acts in Mitochondria to Expand Neocortical Progenitors by Glutaminolysis, Neuron, 2020
脊椎動物の「休眠状態」の分子メカニズム





エラー;Saw ASCII character 10 but expected 33-based Phred qual.
今回は管理人が困ったトラブルの解決法
~seqのマッピングで困ったことが起きた。
fastqをトリミングする前はちゃんとマッピングされる(bowtie)のに、トリミングするとなんだか下のようななエラーが出てしまうというもの。。
Saw ASCII character 10 but expected 33-based Phred qual.
ググってみるとちゃんとダウンロードできているか?とか書いてあるが、トリミング前は問題なく走るのでそこではないだろう。
で、色々調べていると、
トリミングで0bpのリードが出てきてしまうのが原因らしい。
そういうわけで
cutadaptのオプション、-mで1bp以上のリードだけとってくればよかったらしい。
(実際これで解決する)
とくにウェット系の人だと同じようなことで困る人も多いかもしれないので、今後もぼちぼち管理人がつまづいたエラーをあげていこうかな。。
発生時計の同調メカニズム
★今回は筆頭著者の吉岡さんからコメントを頂きました。ぜひ最後までご覧下さい!★
何兆個もの細胞からなる私たちの体は、受精卵というたった一つの細胞から生まれる。この受精卵から体が出来上がる過程において、多くの現象があらかじめ決められたタイミングで自律的に進行していく。
この発生タイミングを決める発生時計が細胞内で正確に時を刻み、細胞間で厳密に同期することが、複雑で精密な個体の発生を可能にするために極めて重要である。
これまでに発生時計が個々の細胞内で時を刻むメカニズムについては数多くの研究からその一端が明らかになりつつある。しかしながら、発生過程において個々の細胞の発生時計がどのように他の細胞と同期し、適切なタイミングでの運命転換を細胞の集合体として可能にしているかはあまり明らかではなかった。
そこで今回、体節形成をモデルにして細胞間で発生時計が同期するメカニズムに迫った論文を紹介する。

-----
発生時計の研究のモデルとしてよく使われるのが、背骨や筋肉の基となる体節が形成される前駆組織であるPSM (presomatic mesoderm, 未分節中胚葉)である。
興味深いことに、マウスPSMにおいては個々の細胞でHes7やLfngといった遺伝子の発現が約2時間という周期をもって振動(オシレーション)することが知られる。

これまでに、これら遺伝子発現の振動にはDll1やNotchの糖鎖修飾の機能を持つLfngが重要であることが分かっていて、LfngをKOすると組織レベルのHes7のオシレーションの振幅が小さくなり、体節形成が異常になることが報告されてきた。
しかしLfng KOによるオシレーション振幅の減弱、あるいは体節形成の異常は
①PSMのそれぞれの細胞におけるHes7の振幅が小さくなったことが原因か、
②細胞間のシンクロができなくなったことが原因か、
③両方ともが原因なのか
は明らかではなかった。
なぜなら、従来の解析法(主にライブイメージング)では解像度が低く、1細胞レベルで何が起こっているかわからなかったからだ。
そこで筆者らは、Hes7-Achilesという蛍光レポーターを新たに作製し、PSMの組織カルチャーを行うことにより、1細胞レベルでオシレーションを解析した。
その結果、Lfng KOマウスでは、1細胞あたりのHes7発現の振幅、周期といったオシレーションの異常とともに、周囲の細胞とのシンクロの度合いの低下が観察された。
Legend;Lfng KOではHes7の発現の振幅が小さく、細胞間のシンクロの度合いも低下していた。

---
では、Lfng KOの振幅の低下は個々の細胞における内在のオシレーションの振幅の低下に由来するのだろうか、それとも、細胞間のシンクロの異常に由来するのだろうか。
この疑問を解決するため、筆者らは、細胞をバラバラにまき隣接する細胞とは接触しない条件において、Hes7の発現を観察した。その結果、LfngをKOしてもHes7のオシレーションの振幅に大きな変化はなかった。このことから、PSMで観察されたLfng KOのHes7振幅の減少は、細胞間のシンクロの異常によって引き起こされた可能性が示唆された。
では、細胞間のシンクロを制御するにあたって、Lfngはシグナルを受け取る側の細胞で重要なのだろうか?それともシグナルを受け渡す側の細胞で重要なのだろうか?
この点に迫るため、次に筆者らは、コントロールとLfng KOの細胞を混ぜた
- 少数のWTの細胞をWTの細胞中に混ぜた時 (1:20)
- 少数の WTの細胞をLfng KO細胞中に混ぜた時 (1:20)
- 少数のLfng KO細胞をWTの細胞中に混ぜた時 (1:20)
の3条件において、Hes7のオシレーションの様子を観察し、少数の細胞と多数の細胞の間でのオシレーションのタイミングのズレを定量した。

このとき驚くべきことに、bのWT細胞では、周囲のLfng KO細胞よりも1/8周期早くHes7の発現がオシレーションしていることが分かった。
このことから、シグナルの送り手の細胞でLfngがノックアウトされている場合には、Notchシグナルの伝達速度がWTよりも速くなる、すなわち送り手の細胞においてLfngがNotchシグナルの伝達を遅めている可能性が示唆された。
一方、cのようにシグナルの受け手の細胞でLfngがノックアウトされた場合には、Hes7のオシレーションの振幅が小さくなっており、周囲のWTの細胞と位相が同期していなかった。
このことから、受け手の細胞でLfng がノックアウトされると、周囲のWTからのDll1シグナルに正常に応答できていない、すなわち受け手の細胞におけるLfngは特にNotchを受け取る過程において、Hes7オシレーションを増幅している可能性があると考えられた。
これらのデータから、送り手の細胞においてLfngはNotchシグナル伝達を遅める役割と、受け手の細胞においてシグナルを受け取った時のHesの振幅を大きくする役割がある可能性が示された。
さらに数理モデルにおいても、LfngによるNotchシグナル伝達の時間遅れの調節は同位相のオシレーションに重要であることが示唆された。
---
では、Lfngノックアウトで早くなってしまっているシグナル伝達を人工的に遅くすることで、Lfngノックアウトの表現型を回復させることができるだろうか?
そこで筆者らは、ES細胞から誘導したPSM様細胞に431分子をかけ、シグナル伝達の遅れを引き起こす分子があるかをスクリーニングした。その結果、26 分子がHes7の振動周期を10min以上長くすることを発見する。
最終的に、KYO211という分子がLfng をノックアウトした PSM細胞でHes7のオシレーションと振幅の大きさと同期率をある程度レスキューした。
このことから、シグナル伝達の遅れがLfngのノックアウトによる表現型をレスキューできることが分かった。
---
結果は以上のような感じで、この研究から、新しいツールにより単一細胞解像度でオシレーションの様子を観察できるようになり、Lfngにより生み出される細胞間のシグナル伝達の時間遅れが細胞集団としてオシレーションを同調させるのに重要であることが分かった。
この結果は体節形成の異常を治療する方法の確立につながるだけでなく、生物がどのように時を刻んで正常な発生を可能にしているかという生物学の根源的な疑問に近づくヒントになる可能性がある。
---
★筆頭著者の吉岡さんからコメントです!
私たちの研究結果をご紹介頂き、ありがとうございます!
今回の論文の出発点は、マウスにおいて未だ実現していなかった、PSMのライブイメージングによる「体節時計遺伝子のオシレーションの一細胞レベルの可視化」です。この解析システムの構築は、理化学研究所 脳神経科学センターの宮脇敦史先生、新野祐介先生が開発された新規の蛍光タンパク質Achillesを用いることで劇的に進みました。
次にこのシステムを最大限に使って、今まで解っていなかった何を明らかにできるか?ここは本当に手探りでしたが、幾つかの変異体を観察する中で、手がかりをつかみ、あの手この手(分散培養、共培養、数理シミュレーション、オプトジェネティクス)でLfngを介した同期機構の解明にアプローチしました。自然界に広く見られる様々な振動現象にも共通する可能性のある新規の知見を、マウスを使った実験で示せたことは、意義がある仕事ができたのではないかと思います。
吉岡はレポーター開発、ライブイメージング、画像解析、数理シミュレーション、オプトジェネティクスに関しては完全に初心者でしたので、たくさんの方々にお助けいただきました。特に数理シミュレーションは東大の郡宏先生との共同研究で行いましたが、このような複雑でダイナミックな現象を理解する上では必須のツールであると感じました。
実は7年かかったプロジェクトでして、途中大変な局面は色々ありましたが、試行錯誤しながら、色々な発見と学びがあり概ねずっと楽しかったです。
個人的には1回目のリバイスを返す少し前に出産を致しまして、産後一ヶ月はゆっくり休みましたが、その以降はずっと怒涛の日々を駆け抜けました。寝不足のあまり記憶がうっすらとしかありません。(緊急の出産だったのでこのような成り行きとなりましたが、かなり身体は負担を感じましたので、人にお勧めするものではないです。)
ライフプランと研究生活とのすり合わせはなかなか難しいですが、まあ何とかなるさ〜と思いながらやっています。これからも価値ある面白い仕事を続けたいです。
---
掲載論文
Coupling delay controls synchronized oscillation in the segmentation clock, Nature, 2020
(リンク)
