私たちのゲノム情報をのせたDNAは、
細胞核の中でヒストンやその他の非ヒストン性タンパク質群と共に
クロマチンを構成する。
クロマチンは一般に緩い構造を取ると遺伝子発現が活性化しやすく、凝集した構造を取ると遺伝子発現が抑制されやすい。
このようにクロマチンの凝集度の制御は、遺伝子発現の制御にとても重要である。
これまで、
クロマチンの凝集を制御する代表的な因子として
HP1(Heterochromatin protein 1)という因子が知られてきた。
HP1は、抑制性のヒストン修飾であるH3K9のメチル化に結合するクロモ
ドメインと、
ダイマー化に重要なクロモシャドウ
ドメインという二つの
ドメインを持つ因子である。
古典的には、HP1は二つのH3K9me3を含む
ヌクレオソーム同士を架橋する構造を取ることで、
クロマチンを凝集させると考えられてきた。
さらに近年、新たなメ
カニズムとして、HP1は相分離を引き起こすことで
クロマチンの凝集を促進することが分かってきた。
しかしながら、HP1がどのような分子メ
カニズムで相分離を引き起こしているのかは不明である。
今回、HP1はなんと、
ヌクレオソーム中のヒストンの構造を変化させることで、
クロマチンの凝集、相分離を誘導している可能性を明らかにした論文を紹介する。

今回紹介する論文
HP1が
クロマチンを凝集させるメ
カニズムに迫るため、筆者らはまずHP1と
ヌクレオソームがどのように相互作用しているかより深く検証しようとした。
クロスリンク
質量分析では、タンパク質を混合し、架橋剤で近接した
アミノ酸を架橋したのちにタンパク質を切断し、
質量分析を行う。
これによって、どの
アミノ酸とどの
アミノ酸が相互作用しているかを明らかにすることができる。
この結果、HP1のクロモ
ドメインとH3が相互作用することや、HP1のクロモシャドウ
ドメインが
H2Bと相互作用することが分かった。
このとき興味深いことに、HP1の存在下ではH3とH3、H4とH4のように、コアヒストンの相互作用にも変化が起きていることが分かった。
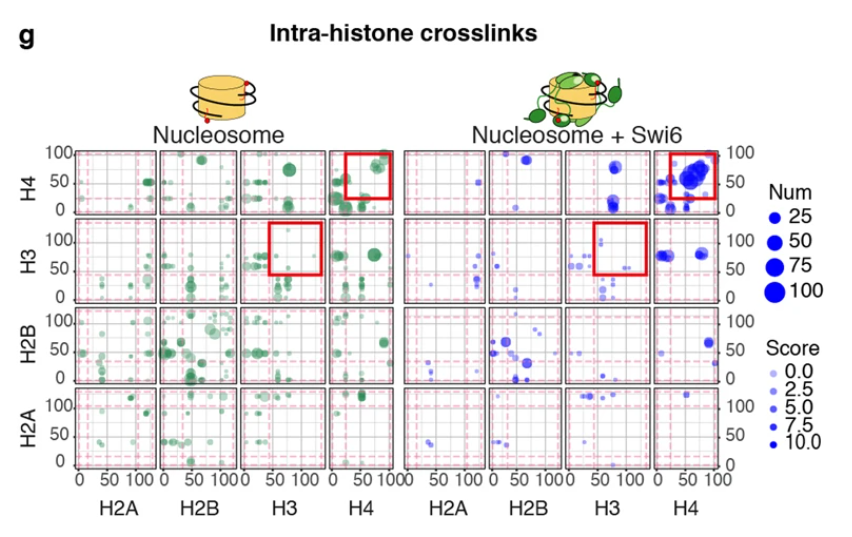
クロスリンク質量分析の結果。丸が大きいほど相互作用が大きい。Swi6(HP1の酵母ホモログ)存在下では新たなH3-H3、H4-H4相互作用が生まれていることが分かる。
これは、
HP1によってコアヌクレオソームの構造が変化している可能性を示唆する。
---
そこで、HP1が
ヌクレオソームの構造変化を起こしている可能性にさらに迫るために、筆者らは水素-
重水素交換
質量分析と、NMRを用いた解析を行った。
説明は大変なので実験手法の詳細は省くが、この結果、HP1によって
ヌクレオソームは通常では隠されたヒストンの
アミノ酸残基が表面に露出するような構造になることが分かった。
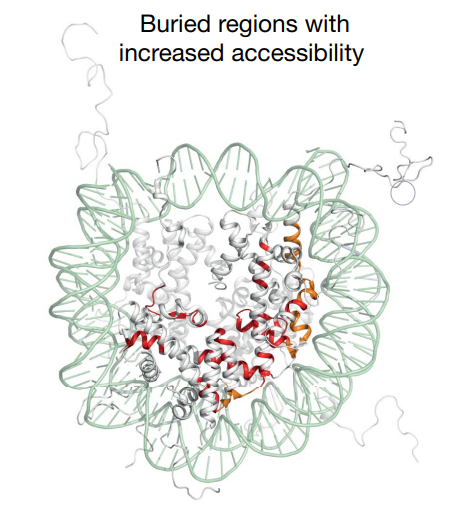
水素-重水素交換質量分析の結果のモデル。通常は表面に露出していない赤く塗られたアミノ酸がHP1存在下では表面に露出してくる。
---
この問題にアドレスするため筆者らは、H3とH4に
システイン残基を入れる点変異を導入し、S-S結合で架橋することで
ヌクレオソームの構造変化が起きにくい変異体を作成した。
また構造変化が起きにくい
ヌクレオソームを用いた場合、HP1による相分離能も低下していることが示された。
---
これまで非ヒストン性タンパク質やヒストン修飾などによる
クロマチン制御メ
カニズムが多数報告されてきたが、コア
ヌクレオソームの構造自体はほとんど変わらないと考えられてきた。
-----
コメント
・たしかに
ヌクレオソームの構造自体で凝集状態や相分離の状態が変わるというのは概念的に新しいかも。因果関係はヒストン変異体の実験しかないので、"
ヌクレオソームの構造変化→凝集/相分離"がどれだけそれらしいかは疑問が残るが。
・細胞内でも同じようなことが起きているのか?というのはとても気になる。今回の場合、"
ヌクレオソームの構造変化は起こさないHP1の変異体"が取れるとよいのだが、難しそう。
・このようなメ
カニズムはどれだけHP1特異的な現象なのだろうか?ほかの因子やヒストンバリアントでも
ヌクレオソームの安定性が変化したりするのだろうか?Generalなメ
カニズムだともっとすごい。
---
今回の論文
HP1 reshapes nucleosome core to promote phase separation of heterochromatin, Nature, 2019
S. Sanulli, M. J. Trnka, V. Dharmarajan, R. W. Tibble, B. D.
Pascal, A. L. Burlingame, P. R. Griffin, J. D. Gross & G. J. Narlikar


