ニューロンの多様性を作るメカニズム
私たちは常に外界からの情報を受け取り、処理し、行動に結びつけている。
ご存知のように、これらの情報処理を行うのに重要な器官は"脳"である。
人間には非常に多くのニューロンが存在するとされているが、
とても面白いことに、それぞれのニューロンはそれぞれ異なる特性を持ち、多様性があることが知られている。
多様なニューロンがぞれぞれのあるべき特性を獲得することは正常な脳機能に必須である。
-----
この中でこれまでに、ニューロンの多様性を生み出すのにプロトカドヘリン、という遺伝子が重要なことが報告されてきた。
プロトカドヘリンは細胞間接着で有名な因子、カドヘリンのスーパーファミリーに属し、細胞間の接着を制御する、細胞表面タンパク質である。
とてもとても興味深いことに、このプロトカドヘリンは多数のエクソンを持ち、その一つだけが1細胞(の1アレル)から選ばれて発現するということが知られている(Esumi et al., 2005など)。
下の図も参考に。
つまり、プロトカドヘリン(Pcdh-α)のV領域に存在する12個のエクソンα1~12のうち、一つだけが選ばれて発現する。
(ちゃんと言うならばプロトカドヘリンの一種、αとγがこのような制御を受ける。)
このように、プロトカドヘリンは1細胞ごとに発現するサブセットが異なる状態になる。
-----
この細胞ごとにプロトカドヘリンのサブセットが異なる性質は、脳発生にもとても重要であることが知られている。
一つ例をあげる。
この自己忌避の分子メカニズムは長い間不明であった。
ところが2012年、面白いことに、同じプロトカドヘリンのサブセットを発現している突起は互いに反発することが報告された。
この論文ではプロトカドヘリンの種類が一つになると(多様性がなくなると)自己忌避が抑制され、回路形成に異常がみられることを報告している。
すなわち、プロトカドヘリンサブセットがランダムに発現することがニューロンの多様性を生むのに重要である。
------
では、発現するプロトカドヘリンのエクソンはどのようにして選ばれるのだろうか??
------
(細かいが、プロトカドヘリンの発現量は低いのでcapture RNA seqというのを使っている。Cieslik, 2015)
すると、驚くべきことに、いくつかのプロトカドヘリンのエクソンからの転写がみられるとともに、プロトカドヘリンエクソンのアンチセンス(DNAの逆側、本来遺伝子をコードしない遺伝子)からRNAが発現していることが分かった。
これだけでも面白いがさらに、このノンコーディングRNAの転写がどこから開始されるのかを検証すると、このノンコーディングRNAは発現しているロトカドヘリンエクソンのセンス鎖RNAと同じプロモーターから転写が始まっていることが分かった。
*このように同じプロモーターから複数の転写物を出すようなプロモーターをconvergent promoterというらしい。珍しいし興味深い。
*これは、おそらく筆者らも想像していなかった結果だろう。とても驚き。
-----
- 単にプロトカドヘリンのエクソンが選ばれた結果発現しているものなのだろうか?
では、どのようにしてこの可能性を検証すればよいだろうか?
*CRIPSRa…CRISPR-cas9システムで用いるDNA切断酵素cas9のDNA切断活性をなくす。さらにcas9に転写を活性化させるタンパク質を結合させておく。これにより、ガイドRNAの配列依存的に転写を活性化させることができる。という系。
-----
詳細は省くが、彼らのモデルでは、
という流れをとるようだ。
さらに筆者らはin vivoにおいて、このスキームが重要であるかを検証した。
具体的にはDNAの脱メチル化を強制的に活性化させるため、DNA脱メチル化酵素Tet3の過剰発現マウスを作成し、解析した。
すると、Tet3を過剰発現すると、DNAの脱メチル化が亢進し、エンハンサーに最も近いプロモーターをもつプロトカドヘリンのエクソンが選択される傾向になることが分かった。
これは、Tet3の過剰発現によってランダムなプロトカドヘリンのエクソン選択がなくなってしまうことを意味する。
この結果によりDNAの脱メチル化がin vivoでも確かに重要であることが示唆された。
同様に、プロモーター-エンハンサーのループ形成で重要な役割をもつRad21を欠損させると、ループがなくなりプロトカドヘリンの発現も減少することを明らかにしている。
これらの結果から、ノンコーディングRNAの発現→DNAの脱メチル化→CTCFによるプロモーター-エンハンサーループの形成→コーディングRNAの発現、という流れがin vivoでも働いている可能性が示唆された。
-----
以下モデル図をお示しする(参考論文から引用)。
繰り返しにはなるが、
初めはセンス鎖からもアンチセンス鎖からも発現がない。
→DNAの脱メチル化(vivoでもtet3を介しているかは?)
→プロモーター-エンハンサーのループ形成
→選ばれたプロトカドヘリンエクソンの発現
という流れになる。

-----
素晴らしい研究ではあるが、気になる点もいくつかある。2つを紹介。
-----
さらに、最近シングルセル解析の発展により、ニューロンに限らず多様な細胞種でその多様性が報告されるようになっている。
一方、なぜ多様性が生まれるのか?という点についてはあまり研究が進んでいないように思われる。
これからの研究がとても楽しみ。
- 関連記事紹介
嗅覚受容体も細胞ごとに発現する遺伝子が異なることが知られている。
そのメカニズムに迫った論文を紹介しています。
-----
参考
- Antisense lncRNA Transcription Mediates DNA Demethylation to Drive Stochastic Protocadherin α Promoter Choice, Cell, 2019
- http://first.lifesciencedb.jp/archives/8634 (プロトカドヘリンの図の引用)
ノックアウトとノックダウンの表現型が違うのは?_2
前回の記事で、ある遺伝子をノックアウトした時にその遺伝子に似た機能を持つ遺伝子の発現が上昇する"コンペンセーション"のメカニズムについてまとめた。
まとめると前回紹介したところまでで、
ノックアウトで似た遺伝子の発現が上がるのは
ノックアウトによる変異型RNAが似た遺伝子の発現を制御するから、
という可能性が示唆された。
-------
では、RNA分解からどのように遺伝子発現制御に結びつくのだろうか。
エピジェネ因子と相互作用することが報告されてきた。
そこで、
筆者らはエピジェネ因子がコンペンセーションに関わるのではないかと考えて、
siRNAスクリーニングを行った。
その結果、いくつかのエピジェネ因子をノックダウンするとコンペンセーションが起きなくなることが分かった。
この中でも、WDR5という因子のノックダウンで最も強い影響がみられた。
WDR5はCOMPASS複合体というやつの構成因子の一つである。
COMPASSはヒストンH3のK4にメチル化(H3K4me3)を入れることで遺伝子発現を上昇させる、と考えられている。

このため、
ナンセンス変異RNAはH3K4me3を介して遺伝子発現を制御する可能性が示唆された。
-----
では、コンペンセーションが起きるときにH3K4me3の修飾量は増えているのだろうか?
筆者らは免疫クロマチン沈降法(ChIP)を行うことでこの可能性を検討した。
その結果、コンペンセーションが起きる際に、実際に発現が上昇する遺伝子でH3K4me3修飾量が増加していることを見出した。
次に、本当にH3K4me3がコンペンセーションに大事かを検証するため、
Wdr5, Setd1a, rbbp5といういくつかのCOMPASS複合体構成因子のノックダウンを行った。
その結果、どの因子をノックダウンしてもコンペンセーションが起きなくなることが分かった。
すなわち、 H3K4me3がコンペンセーションに大事である可能性が示唆された。
-----
とはいっても、RNAからH3K4me3の間がどうにも理解しづらいと思うかもしれない。
筆者らは興味深いことに、
本来細胞質で働くはずのRNA分解複合体(の一つUpf3b)が、
核においてWdr5と複合体を形成することを見出す。
そこで筆者らは(少し想像が入るが)
そのRNAをガイドとして配列が似た遺伝子の発現をONにするというモデルを提唱する。
-----
結果は以上で、RNA分解から遺伝子発現をH3K4me3が担っていそうなことが示された。
以上から
"ゲノムのナンセンス変異→ナンセンス変異RNA分解→H3K4me3修飾→コンペンセーション"という流れが見えてきた。
彼らはこれをナンセンス変異依存的転写補償(nonsense-induced transcriptional compensation, NITC)と名付け、
生命科学界の新しい概念として提唱している。
-----
この研究は、ノックダウンで表現型がでるがノックアウトではでない、という彼らの報告した知見を基にしている。
ノックアウトによるコンペンセーションはよくあることで、
生命科学研究者なら一度はコンペンセーションなんて何で起きるんだ、と思うことだろう。
筆者らはそのふとした疑問をきちんと生命科学研究に落とし込だ点で非常に素晴らしいと思う。
また、この研究の面白さは単にノックダウン動物におけるコンペンセーションに留まらない。
これまでの報告で、健常な人間も結構ゲノムにナンセンス変異を持っていること、
いくつかの疾患ではミスセンス変異よりもナンセンス変異の方が症状がマイルドなこと、が知られてきた。
今回の結果は、ナンセンス変異はコンペンセーションを誘導することで、
その遺伝子の機能を補完できるようにしていることを示唆している。
すわなち、ナンセンス変異依存的転写補償は、
ゲノムに入ってしまうナンセンス変異で大きなダメージを受けないようなバックアップシステムとして生体に備わっていると想像される。
生き物はこのような精緻な仕組みを長い進化の過程で獲得してきたのだろう。
生物の進化は伊達に何億年もかかっているわけではない。
---
よろしければ他の記事もどうぞ。
-----
参考
- Genetic compensation triggered by mutant mRNA degradation, Nature, 2019
Mohamed A. El-Brolosy, Zacharias Kontarakis, ... , Antonio J. Giraldez & Didier Y. R. Stainier
- PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components, Nature, 2019
Zhipeng Ma, Peipei Zhu, ... , Jinrong Peng & Jun Chen
ノックアウトとノックダウンの表現型が違うのは?_1
生物はある遺伝子が欠失した時でも、同じような機能を持つ遺伝子を発現させるメカニズム(Genetic compensation、以下"コンペンセーション")を持っている。
よくあるのは、ある遺伝子をノックアウトした際に、ファミリー遺伝子の発現が増加するもの。
(例えば、β-actionをノックアウトしたら似た機能を持つγ-actinの発現があがりますよ、みたいなやつ。例えばですよ。)
これはある遺伝子の機能を調べようと思っても、似た遺伝子がその遺伝子の機能を補完してしまうため、非常に厄介である。
一方で、生体では一個の遺伝子が壊れても生きられるようにする優れたメカニズムとして使われている。
コンペンセーションのメカニズムを解明することは、
遺伝学研究を効率的に進めるヒントになるだけではなく、
生体が恒常性を維持する精緻な仕組みの解明につながる。
しかしながら、
今回の論文ではGenetic compensationを引き起こすメカニズムに迫り、
ノックアウトによって生じるナンセンス変異型RNAが、ヒストン修飾を介して類似した遺伝子の発現をONにすることを示した。
------
まず、 何がコンペンセーションを引き起こすのだろうか?、という問題にアドレスした。
このため、筆者らはコンペンセーションを引き起こすようなモデル動物を作成した。
ゼブラフィッシュにおいて、6つの遺伝子に対して、途中で終止コドンが入るようなナンセンス変異を入れることでノックアウトを行った。
このとき、このKOゼブラでコンペンセーションが起き、KOした遺伝子に似た遺伝子の発現が上昇することがみられた。
(KOした遺伝子は、hbegfa, vcla, hif1ab, vegfaa, egfl7, alcama。
補償するのはそれぞれ対応してhbegfb, vclb, epas1a and epas1b, vegfab, emilin3, alcamb)
Genetic compensationの原因として、まず思いつくのはタンパク質の欠損だろう。
すなわち、あるタンパク質がないことでフィードバックが働きコンペンセーションがおこる可能性だ。
この可能性を検証するため、筆者らはそれぞれのKOゼブラに対して、正常タンパク質をコードするRNAを打ち込んだ。
このゼブラでは正常なタンパク質が発現するため、KOによるタンパク質の欠損は解消される。
このとき、驚くべきことに、正常タンパク質をコードするRNAを打ち込んだ場合でも、
KOゼブラではKOした遺伝子に似た遺伝子の発現が上昇していた(コンペンセーションが起きていた)。
この結果は、今回の実験に用いた遺伝子群に関しては、
Genetic compensationはKOされた遺伝子のタンパク質が欠損していたためにおこる現象ではない、ことを示唆する。
---
これは筆者らにとっても少々意外だったと思うが、
筆者らは実験を続けるうちにある種の規則性を見出す。
すなわち、何ラインも用意したKOゼブラのうち、
変異型RNAが分解されずに残っているラインではコンペンセーションが起きにくい、傾向である。
この傾向から、筆者らはKOされた遺伝子のRNAが分解されることがコンペンセーションを惹起する可能性を考えた。
これを検証するため、(ナンセンス変異)RNA分解経路を、これを担う因子(Upf1)のノックダウン、および試薬、によって阻害した。
すると驚くべきことに、(ナンセンス変異)RNA分解経路を阻害するとコンペンセーションは起きないことが分かった。
さらに、筆者らは、5capがついていない分解されやすいRNAを注入するとコンペンセーションを起こすことができることも示している。
これらの結果は、(ナンセンス変異)RNA分解がコンペンセーションに必要である可能性を示唆する。
*RNA分解がコンペンセーションに重要というのは結構意外だし面白い発見。
------
では、そもそもRNAを転写しないような変異型ではコンペンセーションは起きないのだろうか?
筆者らは、プロモーターや遺伝子全体を欠失させ、RNAが発現しないKOラインを作成して解析した。
すると、このKOラインではコンペンセーションは起きないことが分かった。
すわなち、RNAが発現しない状態であればコンペンセーションは起きないことが示唆された。
-----
これまでの結果で変異型RNAの分解がコンペンセーションに大事だということが分かった。
しかしなぜ、都合よく似た機能を持つ遺伝子の発現を上げることができるのだろうか?
筆者らは3つのKOラインでRNAseqを行うことで、KOで発現があがる遺伝子の特徴を解析した。
すると、KOで発現の上がる遺伝子は、ノックアウトした遺伝子と配列が似ていることが分かった。
すなわち、ノックアウトによって生じた変異型RNAがガイドとなることで
似た配列を持つ遺伝子の発現を上げる、というモデルを提唱している。
まとめ図(論文から拝借)
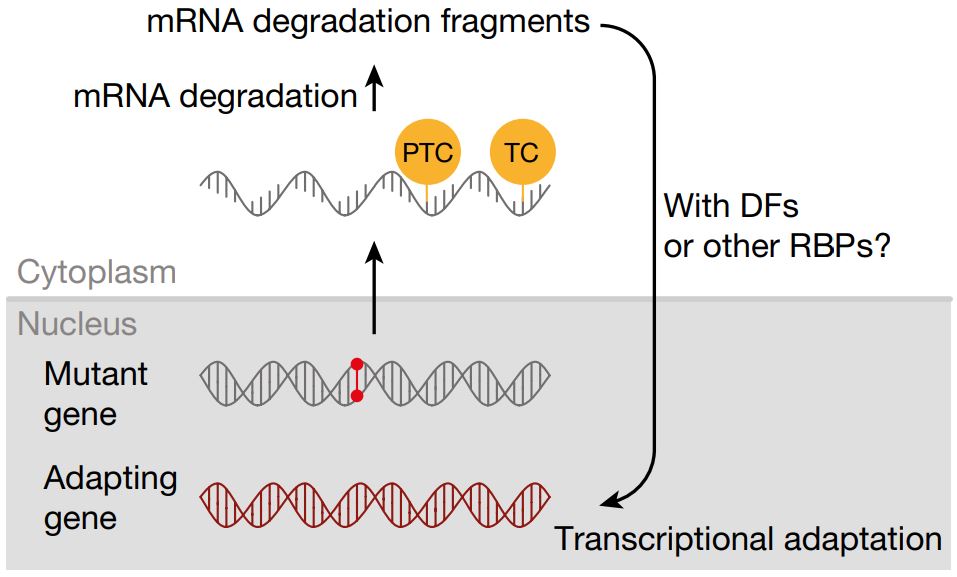
------
生命科学研究において、ある遺伝子をノックダウンすると表現型がみられるが、
ノックアウトすると表現型がみられないということはしばしばある。
今回の論文ではノックアウトによってナンセンス変異が生じることが、
コンペンセーションを引き起こしてノックアウトした遺伝子の機能を補完する可能性を示した。
ノックアウト動物を使用されている方はナンセンス変異で終わっているか、変異RNAが分解されているかにご注意を。
次回続編として、より詳細な分子メカニズムと生物学的意義について紹介したい。
----
参考
Genetic compensation triggered by mutant mRNA degradation, Nature, 2019
Mohamed A. El-Brolosy, Zacharias Kontarakis, ... , Antonio J. Giraldez & Didier Y. R. Stainier
赤外線が見える薬!?
私たち人間は、多くの情報を視覚から得ている。
人間が感知することのできる光は
波長がおよそ400nm~700nmの間にある可視光のみである。
一方で、世界には可視光以外の波長の光にもあふれており、
もし「可視光」(波長400nm~700nm)以外の光を「みる」ことができれば、人間の認識能力を拡張することができる。
しかしながら、700nm以上の波長の光(赤外線)は光受容体を活性化できるだけのエネルギーをもたず、
赤外線は当然人間には「みる」ことのできないものとされてきた。
今回紹介する論文では驚くべきことに、
赤外線を感知することを可能にする特殊な微粒子を作成した。
さらにこれをマウスの目に打ちこむと、
マウスは赤外線を感知することができるようになることを示した。

-----
この赤外線感知薬のミソとなるのは、
赤外線をあてると可視光領域の光を放出する微粒子の作成だ。
例えば、2017年のNatureに報告されているように(参考1)、
これは波長980nmあたりの赤外線をあてると、535nmの波長の光が返ってくるようなものである。
これを使えば、赤外線を可視光の波長に変換することができる。
ただし、この微粒子は水に溶けず、生体に適応することができなかった。
そこで筆者らはレクチンの一つであるコンカナバリンAをこの微粒子に結合した。
この新しい微粒子は水に溶け、生体で使用することが可能になった。
-----
そこで筆者らは、この赤外線感知薬をマウスの目に打ち込んだ。
このとき、細胞が死んだりしないこと、つまり激烈な毒性はないことを確かめている。
さらにマウスの目に980nmの光を当てると光受容体が活性化すること、
すなわち赤外線に光受容体が反応することをみている。
-----
では、赤外線感知薬を打ち込むと本当に赤外線が見えているのだろうか?
筆者らはマウスの行動実験で検証を行っている。
いくつかの実験を行っているが、そのうち一つを紹介する。
マウスは水を嫌うことが知られている。
下の図のように2つの場所を用意し、片方だけに水から逃げられるような台を用意しておく。
(下の図では左側)
マウスはこの台のある方に移動しようとする。
このとき、赤外線で縦線と横線を用意しておき、縦線の方に台があるようにする。
もし赤外線をみることができれば、マウスは縦線の方にいくようになる。
実際、赤外線感知薬を打ったマウスは赤外線を感知して台のある方にすぐに行くようになることを示している。
ちなみにこのとき、普通の視覚には影響はないとは言っている。
(がどれくらいの程度で"影響がない"のかは不明)
以上から、筆者らが開発した赤外線感知薬によって、赤外線で光受容体が活性化すること、この試薬を打つことで赤外線を感知した行動を行うようになること、が示された。
これは生物の限界を突破し、認識の範囲を拡張するという点で非常に大きな一歩である。
-----
では、この赤外線感知薬で人間も赤外線が見えるようになるのだろうか?
NatureのNews記事によると、現在のところ、この試薬をすぐに人間に適用するのは厳しいようだ。
まず、この試薬には重金属が使用されているので、長期的には毒性があると考えられる。
この問題を解決するために、現在重金属を使わない試薬の開発が試みられているらしい。
また、これまで人類は赤外線を非可視光とするように進化してきた。
このため、突然赤外線をみることができるようになると人間の脳が適切に解釈できない可能性がある。
そういうわけで、すぐに人間が赤外線をみれるわけではないらしい。
ただし、疾患の治療などへの応用は期待される。
-----
なかなかキャッチーで面白い論文だった。
自分では全く思いもよらないようなことが可能になるのはすごい。
ただ、赤外線が波長535nmあたりの光に見えてしまうのは色々まずそう......
一回くらいはどんな感じに見えるのか試してみたい
-----
参考
- Mammalian Near-Infrared Image Vision through Injectable and Self-Powered Retinal Nanoantennae, Cell, 2019
- https://www.nature.com/articles/d41586-019-00735-4 (News in Nature)
- Amplified stimulated emission in upconversion nanoparticles for super-resolution nanoscopy, Nature, 2017(1)
iBiologyがすごい
今回は論文紹介ではなくて、
最近見つけた生命科学サイトを紹介したい。
それがこちら。
"iBiology"というサイト。
結構有名らしいが自分は最近知った。
-----
"無償で最先端の生命科学研究を世界中に広めること"を目標としたサイト。
生命科学系のトピックについて20分程度の動画が多数あがっている。
何がすごいかって、講演者がすさまじく豪華なことだ。
例えば、オプトジェネティクスの生みの親、Karl Deisserothが、
オプトジェネティクスの発見についてトークしたり、
じきじきスプライシングの話したり。
Robert Horvitzの講演もある。
他にも、今をときめくPhase separation界のBig name
Cliff Brangwynneとかとか
さらにさらに、
mTORの大御所 David M. Sabatini、
ウーパールーパーの再生で有名な Elly Tanaka、
アストロサイトの Ben Barres
など、本当にすごい。
しかも、結構最近録画されたものも多いので情報も古くなくてよい。
後援も受けているようだし、信頼感もある。
英語の勉強にもなるし(動画は字幕もつけられる)、とてもよい。
いい世の中になったもんだ。
ご参考までに。
スーパーエンハンサー小話_1
生物学には"スーパーエンハンサー"という用語がある。
歴史はそれほど長くはない。
初めに"スーパーエンハンサー"と言い出したのはRichard Youngという大物である。
2013年に彼がのグループがCellにBack-to-backで出した2報の論文が
"スーパーエンハンサー"のおこりである。
* 2報ともlast authorはRichard Young。これは結構すごい。
普通はBack-to-backで出すといえば、
1報ではインパクトに欠ける場合に異なるグループが協力して出すというのが多い。
1グループでBack-to-backするというのは本当にCell2報分ということ。
---
ともかく、スーパーエンハンサーはどのように見つかったのだろうか。
Richard YoungはES細胞の未分化性の分子基盤とかを研究していた。
特にスマッシュヒットとして、
2005年にESの未分化性にSox2,Oct4, Nanogがキーであるということを報告している。
(Boyer et al., Cell, 2005、被引用件数>4000)
*2006年にiPSが報告されるわけだけれど、山中先生の次くらいにiPSに近かった存在かも。
(ただしNanogは必要ではなく、意外にもKlf4が必要なのでそう簡単ではなかったか?)
ということで、Richard Youngらは、
Sox2, Oct4, Nanogの3因子がESの未分化性に重要であることを報告していた。
しかし、この2013年までは
これらの因子がどのように働くかイマイチ分かっていなかった。
-----
そこで、彼らのグループはSox2、Oct4, Nanogが
ゲノム上のどこに結合しているか検証した。
(ChIP-seqというやつで)
すると、驚くべきことに、
これらの因子が時に50kbpにもわたって結合しているゲノム領域があることが明らかになった。
Sox2、Oct4, Nanogはエンハンサーに結合していることは知られていた。
しかし、普通のエンハンサーは高々数百bpなので、
これほどのこの長いゲノム領域は特殊である。
また、このゲノム領域にはメディエーターの結合が強くみられる。
メディエーターはエンハンサー、プロモーターに普遍的に結合するとはずなのに。
いよいよ謎が深いゲノム領域である。
-----
この巨大エンハンサー領域の特徴は何だろうか?
このエンハンサーが制御する遺伝子をみると、
Oct4, Sox2など未分化性の維持に重要な遺伝子が上がってきた。
つまり、この巨大エンハンサーはES細胞の未分化性に重要なキー遺伝子の
発現を制御するゲノム領域であることが示唆された。
では、巨大エンハンサーは通常のエンハンサーに比べて何が違うのだろうか?
さらに、この巨大エンハンサーと普通のエンハンサーをプラスミドにいれて
転写活性化のレベルを検証した。
すると、この巨大エンハンサーを挿入した方が転写が強く活性化することが分かった。
以上をまとめると、
ES細胞のキー遺伝子とメディエーターが強く結合する巨大エンハンサーは
未分化性に重要な遺伝子の発現を強くドライブするゲノム領域であることが分かった。
"スーパーエンハンサー"と名付けた。
これがスーパーエンハンサーのおこり。
-----
さらに興味深いのが、このスーパーエンハンサーは細胞種に特異的で、
それぞれの細胞種の遺伝子発現状態を決めるのに非常に重要である点だ。
例えば、免疫細胞のB細胞では
スーパーエンハンサーはB細胞のキーとなる遺伝子を制御していることが分かっている。
(免疫細胞に限らないことが報告されてきている。)
いまでは一応スーパーエンハンサーを定義する基準というものができている。
細かいので省略するがメディエーターとか、転写因子の結合をみることで探索することができる。
ただし真面目にやるにはちょっと技術的にハードルが高い。
(複数のChIPseq。それなりの解析スキル。)
こういわけで、"スーパーエンハンサー"という新しい概念がもたらされた。
やや参入へのハードルが高いためか、そんなに論文の数は多くはないが、
今後スーパーエンハンサーに着目した論文も増えてくるのではないだろうか?
また、スーパーエンハンサーは創薬ターゲットにもなりそうであることが分かっていて、
実際いくつかは製薬会社が既に開発をはじめている。
次回はそこら辺のことを紹介しようと思う。
-----
あとは完全に蛇足。
- スーパーエンハンサーはphase separationしている。
これもRichard YoungがScienceに出している。
Coactivator condensation at super-enhancers links phase separation and gene control, Science, 2018
- 細胞種特異的、といえばmiRNAもある。
スーパーエンハンサーとmiRNAも関係しているらしい。
これもRichard Young(とPhillip A. Sharp)がCellに出している。
1stが日本人の方で新着論文レビューに解説が出ている。
柳に雪折れなし? 成体の神経幹細胞における転写後制御
拙ブログでも何度か紹介しているように、
次世代シーケンサーの登場によって、多くの細胞種でRNAseqが行われ、
それらの細胞の遺伝子発現が網羅的に調べられてきている。
その勢いや猪のごとく(猪年だけに?)、
三大紙でもRNAseqを見ない週はない勢いである。
ところがRNAseqを進めるうちに、
最近、研究者たちは不思議なことに気が付き始めた。
いくつかの細胞種では、
その細胞では発現すべきではない遺伝子のmRNA発現がみられるのだ。
例えば、胎生期の神経幹細胞では、
発現するとニューロンに分化してしまうBrn2(ブレイン2)のmRNAが発現している。
これは、未分化な状態を維持しておきたい幹細胞にとってはまずいことである。
(ただし実際のところは幹細胞は、このBrn2 mRNAの翻訳を抑えているらしい(Zahr et al., Neuron, 2018とか)。)
ともかく、このように、
遺伝子発現をみても必ずしもそれはタンパク質量とカップルしない、
ことが分かりつつある。
-----
このようなことから、どのような遺伝子がどの程度タンパク質量とカップルして、
どのような遺伝子はタンパク質量とカップルしないか?というのが研究者の大きな疑問であった。
そこで今回紹介する論文では、成体における神経幹細胞の分化をモデルにして
RNA量とタンパク質量を網羅的に検証し、mTORが翻訳量ひいては細胞運命の制御に重要であることを見出した。
Anaのグループは成体の神経幹細胞のシングルセルRNAseqを先駆けて行ったグループ。
(この成体神経幹細胞のシングルセルは大変competitive。
知っているだけでも他3グループが同じことをやって論文にしている)
ちなみに神経幹細胞の大御所にはAnneさんもいて紛らわしいので注意。
------
成体神経幹細胞は非常に重要な細胞である。
なぜなら、大人になっても新しい神経細胞を生みだす数少ない供給源となっているためだ。
大人になっても神経細胞を生むことは学習や本能行動に重要であることがマウスの研究で明らかになっている。
この成体神経幹細胞が存在するのは二か所、海馬と、脳室下体である。
今回筆者らは脳室下体における神経新生に着目している。
脳室下体の神経幹細胞は、ニューロンへ分化する際に
静止型神経幹細胞→活性型神経幹細胞→早期ニューロブラスト→後期ニューロブラスト→ニューロン
と順々にその状態を変化させていく。
-----
筆者らは始めに、それぞれの分化段階でのタンパク質翻訳レベルを検証した(OPP uptakeという系)。
すると、面白いことに、
静止型神経幹細胞から活性型神経幹細胞になる際に翻訳量全体が増加し、
早期ニューロブラストになる際に翻訳量全体が減少することが分かった。
すなわち、神経幹細胞は分化に伴って翻訳量を制御していることが分かった。
そこで次は、どのような遺伝子のRNAが翻訳による制御を受けているか気になるだろう。
筆者らはRibo-Tagマウスを用いて、分化段階ごとに翻訳量を検証した。
Ribo-Tagマウスはリボソームにタグがついていて、
(ちなみに分化段階ごとにin vivoの細胞でRibo-Tagした例もほとんどないので新しい)
この結果から、神経幹細胞では比較的RNA量と翻訳量は比例するが、
分化し始めるとRNA量とタンパク量が比例しないものが出てくる、
すなわち、分化し始めると転写後の制御がみられるようになると主張している。
(ということで彼らは神経幹細胞ではpost-transciptionalな制御はあんまりないといっている。
ただし、他の論文Yoon et al, Cell, 2018とか先のZahr et al, Neuron, 2018は神経幹細胞でpost-transcriptionalな制御あるといっている。
胎生期と成体で違うということかもしれないし、相対的に分化しかけた方が転写後制御が大きいのかもしれない)
-----
で、肝心のどのような因子が転写後の制御を受けるかだが、
一つはSox2という幹細胞性の維持にとても大事な因子が挙げられるといっている。
Sox2は分化しても割とRNAは残っているが、翻訳は落ちている。
つまり、転写後の制御によって翻訳が抑制されていることが分かった。
次に、翻訳量がRNA量に比べて低い遺伝子についてみてみると、
5'UTRにmTORの標的となる特徴的な配列があることが分かった。
mTORは翻訳量を制御する重要な因子であることが知られている。
そこで、
筆者らはmTORが翻訳量を制御することで細胞運命を制御している可能性を考えた。
端折ってしまうが、筆者らはmTORを活性化、あるいは抑制することで、
成体神経幹細胞と早期ニューロブラストの運命を行き来させることができることを示している。
*ただしこの実験はmTORが大事であることは主張できるが、
翻訳が本当に大事だったのかは主張できない。
翻訳だけを制御するのも難しいので仕方がないことではあるが。
------
以上の結果から、
"転写→翻訳→タンパク質→細胞運命"という「固い」メカニズムというよりは
転写も制御するけど、翻訳量も制御することで細胞運命を制御するという
「緩い」メカニズムで
生体は恒常性を維持している一例が見いだされた。
部分部分はしなやかに作っておいた方が、全体としてはロバストなんだろう。
(タイトルはそういうわけで"柳に雪折れなし"という...)
神経幹細胞に限らず、発現量と同じくらい翻訳量を検証するのも大事になってくる。
幸い、近年はRibo-Tagが結構広まっているので、今後も似たような研究が続いてくれるのではないか。
あとは、発現だけをみても分からない生命現象もあるよというのも大きな教訓。自戒を込めて。
------
参考
Onset of differentiation is post-transcriptionally controlled in adult neural stem cells, Nature, 2019